Isomería – Compuestos de la Cadena Cíclica
Cuando estudiamos compuestos cíclicos, podemos observar el siguiente comportamiento
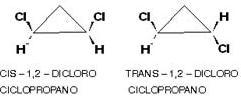
Resumiendo, el compuesto 1,2 di cloro ciclo propano puede presentar sus ramificaciones por encima o por debajo del plano que forma el núcleo del compuesto siendo clasificado como cis o trans.
Isomería de Compensación y Función
OH
CH2 – CH2 – CH3
CH2 – CH2 – CH3
|
OH
No sucede isomería de posición, una vez que las tres valencias del carbono son equivalentes entre si.
Isomería de compensación (o metamateria)
Los isómeros difieren por la posición de un hetero átomo en la cadena carbónica.
Ejemplos:
Isomería de Función
Los isómeros pertenecen a funciones químicas diferentes. Los casos más comunes son:
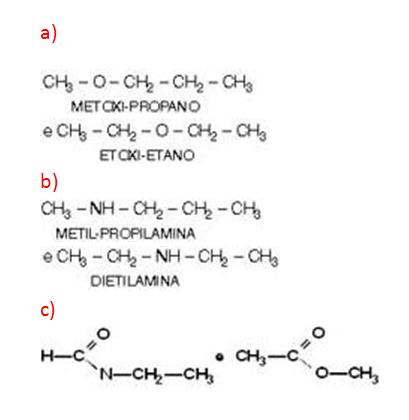
Alcoholes y Éteres
Ejemplo:
CH3__CH2__OH y CH3__O__CH3
ETANOL y MET OXI-METANO
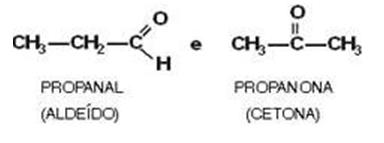
Aldehído y Cetona
Ejemplo:
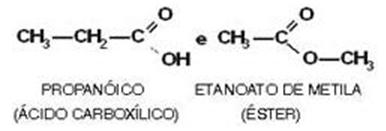
Ácidos carboxílicos y ésteres
Ejemplo:
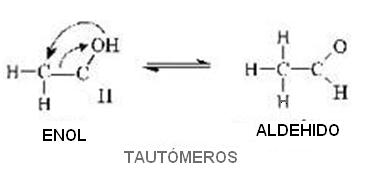
Tautomería
Los dos isómeros quedan en equilibrio químico dinámico.
Los casos más comunes de tautomería son:
Aldehído y Enol
Consideremos, como primer ejemplo, el caso del aldehído acético (CH3 – CHO):
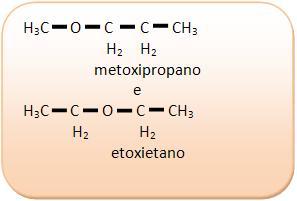
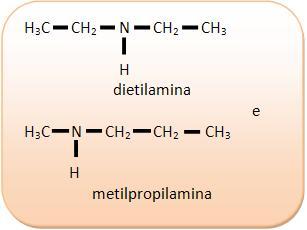
Isomería de compensación o metamería
Los isómeros forman parte de la misma función, poseen la misma cadena, sin embargo presentan una diferencia en la posición del hetero átomo.
Es importante recordar que cualquier función que posea cadena heterogénea, puede presentar esta isomería.
1) C4H10O
2) C4H11N
3) C4H8O2
Isomería de Función o Funcional
Los isómeros pertenecen a funciones químicas diferentes.
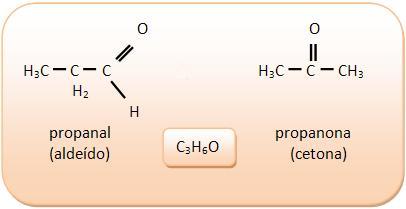
1) Aldehídos y cetonas
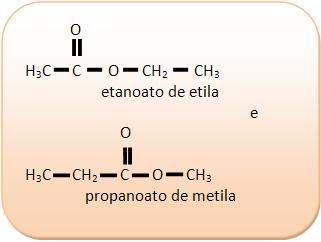
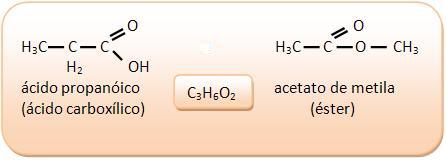
2) Ácidos carboxílicos y esteres
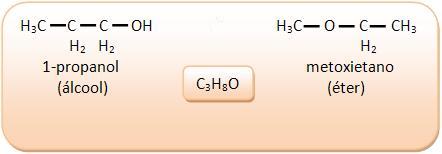
3) Alcoholes y éteres
Isomería de posición
Los isómeros de posición poseen la misma función y la misma cadena, sin embargo, presentan diferencias en la posición del sustituyente de una insaturación, e inclusive de un grupo funcional.
1) C3H8O

2) C4H8
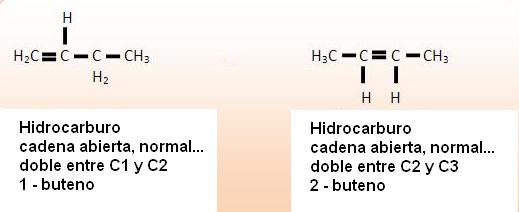
3) C6H6O2
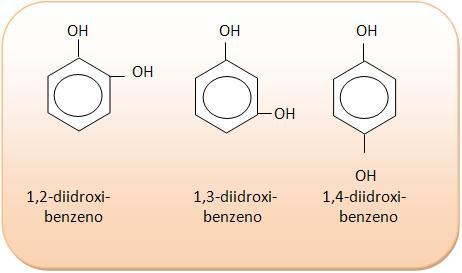
Isomería Espacial
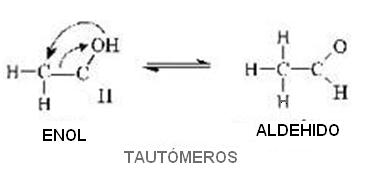
Carbono del Enol (en= doble enlace; ol = alcohol) “se desplaza” hacia el carbono (decimos que el oxígeno sufrió una “transposición”); simultáneamente el doble enlace que estaba entre el primer y segundo carbono se traslada, quedando entonces entre el primer carbono y el oxígeno. Entonces decimos que el compuesto sufrió un reacomodo molecular.
Sin embargo la reacción es reversible, esto es que el aldehído vuelve a transformarse en el enol inicial.
Mas allá que sabemos que toda reacción reversible tiende a un equilibrio dinámico, es lo que sucede con el par aldehído-enol mostrado antes, surgiendo entonces el llamado equilibrio aldo-enólico.
Medidas realizadas en laboratorios muestran que en ese equilibrio, el mayor porcentaje es siempre de aldehído pues él es el compuesto más estable.
Cetonas e enoles
Como segundo ejemplo citamos el caso del equilibrio entre una cetona y un enol que en verdad es totalmente idéntico al caso que presentamos anteriormente.
Isomería Espacial
Los isómeros presentan la misma fórmula molecular, misma fórmula plana, pero diferentes fórmulas estructurales espaciales.
Se dividen en:
Isomería Geométrica (o Cis Trans)
En compuestos de cadena acíclica con doble enlace
1.° ejemplo – Sea el compuesto ClCH2 – CH2Cl; podemos representarlo por el modelo de bolas de la siguiente forma.
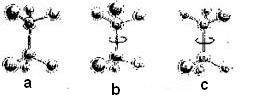
Sin embargo, las tres representaciones indican la misma cosa, pues se trata de la misma estructura espacial, o sea, del mismo compuesto. De hecho el enlace simple entre los dos carbonos puede girar libremente, de ese modo basta “rodar” el carbono superior de la estructura B 120° para que coincida con la estructura A, así como rodando el carbono superior de la estructura c 120°, coincide con b y continuando el giro por otros 120° coincide con A.
En fin, siempre que exista superposición de las figuras ellas estarán representando el mismo compuesto.
2.° ejemplo – Sea el compuesto ClCH = CHCl; utilizándose el modelo de bolas, podemos tener las siguientes posiciones espaciales

Prestemos atención en lo siguiente:
En la primer figura, los dos átomos de cloro están del mismo lado del plano que divide la molécula al medio, esta es llamada la forma CIS (cis = mismo lado).
En la segunda figura, los dos átomos de cloro están de lados opuestos del plano que divide la molécula al medio, esta se llama forma TRANS (trans = a través o transversal).
