Ácido-base, según Lewis
El químico estadounidense, inventor de la teoría de enlace covalente, Gilbert Newton Lewis, completó la historia de las teorías de los ácidos y bases, en 1923, con la introducción de un concepto de ácido y bases, más general que los que ya existían, anteriormente propuestos por Arrhenius y los químicos Bronsted y Lowry.
Lewis, junto a su concepto general, también introdujo el uso de las fórmulas de los electrones representados por puntos así, el empleo de pares de electrones en las representaciones químicas, proviene también de éste modelo ácido-base de Lewis.
Además, Lewis propuso que los ácidos y bases pueden ser identificados por su comportamiento en las reacciones químicas, en lugar de sus propiedades físicas. Esta perspectiva permitió a los químicos entender mejor las reacciones que no se ajustaban a las definiciones tradicionales de ácido y base. Por ejemplo, las reacciones que ocurren en disolventes no acuosos, que no pueden ser explicadas por las teorías de Arrhenius o Bronsted-Lowry, pueden ser entendidas a través de la teoría de Lewis.
Según Lewis, los ácidos y bases se definen como:
Ácido: un ácido de Lewis, se define como una sustancia capaz de compartir, o aceptar un par de electrones.
Base: una base de Lewis, es una sustancia con capacidad para compartir o dar pares de electrones.
De este modo, todas las sustancias que para las teorías de Arrhenius o Bronsted-Lowry, eran ácidos, para Lewis también lo son, ya que coinciden con su teoría, sólo que, Lewis amplia el concepto de ácido más allá de las anteriores teorías, pues según Bronsted, una base es una sustancia aceptora de H^+, pero éste caso es tan sólo un caso particular para las bases de Lewis, pues para él, las sustancias con H^+, son ácidos. Pero muchos ácidos de Lewis, no lo son de Bronsted, como por ejemplo, BF3 (BF3 + :NH3 → F3B NH3).
También existen sustancias de Lewis, que pueden actuar como ácidos, y bases a la vez, estas son sustancias conocidas como anfóteras (por ejemplo, el óxido de aluminio).
En la química orgánica, las teorías de Lewis sobre las bases y los ácido, tienen una gran importancia, en cambio las de Arrhenius o Bronsted-Lowry, generalmente no son adecuadas para la explicación de las reacciones químicas en soluciones acuosas.
Los ácidos, según Lewis, deben su octeto de electrones correspondientes incompleto, y las bases, tienen que tener un par de electrones solitarios.
Una base de Lewis, típica es el amoníaco, y una base, el trifluoruro de boro.
El resultado de la reacción de un ácido de Lewis, con una base del mismo, es un compuesto conocido como, de adición.
Muchos de los ácidos de Lewis, son importantes catalizadores en diversas reacciones orgánicas.
De este modo, se pueden incluir como ácidos de Lewis, a muchas sustancias que no lo eran, o no cumplían a definición de Bronsted – Lowry, conociéndose a éstas como ácidos de Lewis.
También, siguiendo la definición, los protones serían ácidos de Lewis (pues tiene hueco para un par de electrones en su orbital 1s), así como todos los ácidos de Bronsted_lowry.
En una reacción ácido-base, tanto la base como el ácido, comparten un par de electrones, habiendo sido estos, cedido por la base. En esta reacción se forma un enlace covalente, A +: B → A B.
Se utiliza la constante de disociación para medir la fuerza que posea una sustancia ácida, o básica de Lewis, tomando como referencia a otro ácido o base de Lewis. Por ejemplo, para poder comprobar la basicidad de sustancias como el amoníaco, la metilamina, etc., en base gas, se usa como sustancia de referencia al trimetilborano.
Los ácidos fuertes o débiles, como ya habíamos mencionado, se pueden evaluar mediante la contante de equilibrio A + :B ↔ A-B, de donde B, sería la base de referencia.
La escala de la fuerza ácida de Lewis, depende de la base que se haya escogido como referente, de manera que un ácido puede ser más fuerte que otro frente a una base, pero también puede ser en cambio, más débil frente a otra.
Para los ácidos y las bases de Lewis, existen reglas cualitativas que nos permiten poder predecir la fuerza de una sustancia, y estimar incluso, que tipo de base preferirá un ácido concreto o viceversa. Estas reglas se pueden dividir en en:
Bases fuertes, son aquellas sustancias que tienen un átomo que cede, cuya densidad electrónica se deforma difícilmente (polariza), debido a esto, por lo general, el átomo dador es de pequeño tamaño y bastante electronegativo, por ejemplo: F^-, OH^-, O^2-, etc.
Bases débiles, en cambio, son aquellas sustancias que poseen un átomo dador cuya densidad electrónica se deforma fácilmente. Dichos átomos suele ser menos electronegativos, y de mayor tamaño que en las bases fuertes. Por ejemplo: Br^-, I^-, CN^-, CO, etc.
Generalmente, las bases débiles, deberían de ser más fuertes que las bases fuertes, pues ceden con mayor facilidad el par electrónico, en cambio, se han observado que determinados ácidos, forman enlaces bastante más estables con las bases fuertes que con las débiles.
Así, en general, los ácidos que forman mejor los enlaces con las bases fuertes, reciben el nombre de ácidos fuertes, y los ácidos que forman mejores enlaces con las bases débiles, reciben el nombre de ácidos débiles.
Ácidos de Lewis fuertes:
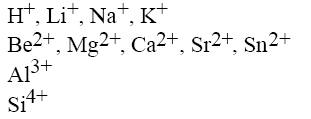
Ácidos de Lewis débiles:
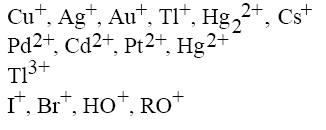
Además de su relevancia en la química orgánica, la teoría de Lewis también ha tenido un impacto significativo en la química inorgánica, especialmente en el estudio de los compuestos de coordinación. Estos compuestos, que son esenciales en muchos procesos biológicos y en la industria, se forman cuando un ácido de Lewis se une a una base de Lewis. La teoría de Lewis proporciona una explicación clara y sencilla de cómo se forman estos compuestos y cómo se pueden predecir sus propiedades.
En resumen, la teoría de Lewis ha ampliado y enriquecido nuestra comprensión de los ácidos y las bases, permitiéndonos entender una gama más amplia de reacciones químicas y predecir con mayor precisión el comportamiento de las sustancias en estas reacciones. A pesar de que ha pasado casi un siglo desde que Lewis propuso su teoría, sigue siendo una herramienta esencial en la química moderna.
