Síntesis del Amoníaco
Para obtenerse un buen rendimiento en procesos industriales, los químicos frecuentemente alteran el equilibrio químico en varios factores al mismo tiempo. La síntesis de amoníaco por el método de Haber es un buen ejemplo.
Consideremos que el equilibrio aquí presentado presenta bajo rendimiento y velocidad casi nula, a 25ºC y 1 atmósfera:
N2(g) + 3 H2(g) <> 2 NH3(g) ΔH = – 92 kJ
Para aumentar la cantidad de NH3 en el menor tiempo posible (recordemos que los procesos industriales precisan de buenos rendimientos y bajos costos), Haber pensó en dos factores: presión y catalizador.
Un aumento de la presión trasladaría el equilibrio para la derecha, en el sentido de menor volumen. Y el catalizador haría con que el equilibrio fuese alcanzado en el menor tiempo posible.
Pero todo esto aún no era suficiente. ¿Como proceder entonces para aumentar la velocidad del proceso?
La mejor alternativa sería aumentar la temperatura, pero en este punto habría un problema serio: como la reacción directa es exotérmica, un aumento en la temperatura aumentaría la velocidad del proceso, pero trasladaría el equilibrio para la izquierda y esto no era conveniente.
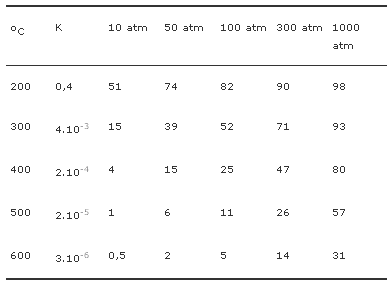
Analizando la tabla a continuación notamos que:
Cuanto mayor la temperatura, menor el rendimiento; cuanto mayor la presión, mayor el rendimiento.
Los efectos de la temperatura y presión en la producción de amoníaco por el método de Haber (% NH3 en equilibrio)
¿Como conciliar entonces estos dos factores antagónicos?
Es en este punto que se destaca el mérito de Haber, pues, a través de su método, el descubrió condiciones económicamente aceptables para producir amoníaco y conciliar esos dos factores: presión de 200 a 600 atmósferas, 450ºC y catalizadores (una mezcla de Fe, K2O y Al203)
Alcanzando un rendimiento de aproximadamente 50% su método permitía aún que las sobras de N2 y H2 fuesen recicladas para producir más amoníaco.
El proceso de Haber es un ejemplo más del impacto que la Química puede provocar en la sociedad.
Además de su uso en la producción de explosivos durante la Primera Guerra Mundial, el proceso de Haber ha tenido un impacto significativo en la industria de la agricultura. El amoníaco producido a través de este proceso es un componente clave en la fabricación de fertilizantes, que son esenciales para la producción de alimentos a escala industrial. De hecho, se estima que hasta la mitad de la población mundial depende de los alimentos cultivados con fertilizantes producidos a través del proceso de Haber.
En 1914, al inicio del la Primera Guerra Mundial, Alemania era dependiente de los depósitos de nitrato de sodio que existían en Chile, usados en la fabricación de explosivos.
Durante la Guerra, navíos de la marina adversaria bloquearon los puertos de América del Sur y Alemania pasó a utilizar exhaustivamente el proceso Haber para producir amoníaco y sus derivados usados en explosivos. Muchos analistas afirmaron que la guerra habría durado menos tiempo si Alemania no hubiese conocido el proceso desarrollado por Haber, un convicto patriota, que también investigó el uso del gas Cloro como arma química de guerra. Debido a estar involucrado en los esfuerzos de guerra del Tercer Reicht, el premio Nobel que obtuvo en Química fue muy cuestionado.
Es interesante y a la vez irónico el hecho de que Haber fue expulsado de Alemania, en 1933 por ser Judío. Ciertamente el no vivió lo suficiente para ver su método contribuir en la producción de alimentos para millones de personas de todas las razas y murió sabiendo como su genialidad era utilizada en la matanza de millones de otras personas.
Además de su impacto en la guerra y la agricultura, el proceso de Haber también ha tenido un impacto significativo en la industria química en general. El amoníaco es un componente clave en una variedad de productos químicos industriales, incluyendo plásticos, pesticidas y productos de limpieza. A pesar de las controversias que rodean a su creador, no se puede negar que el proceso de Haber ha tenido un impacto duradero en la sociedad moderna.