Coeficiente de reparto
Si consideramos una sustancia que es capaz de disolverse en dos solventes que no se pueden mezclar entre sí, la relación entre las concentraciones de esta sustancia en los distintos solventes es el llamado coeficiente de reparto. Este coeficiente es constante para una determinada temperatura, y puede representarse con la siguiente fórmula:
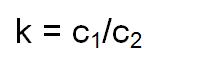
Donde k es el coeficiente de reparto, C1 la concentración de la sustancia en el primer solvente y C2 la concentración en el segundo solvente.
Si tomamos como C1 la concentración de una sustancia en un solvente hidrófobo (solvente apolar, no miscible con agua) y como C2 la concentración de la misma sustancia en agua, tendremos que sustancias cuyo coeficiente de reparto sea elevado, son mayormente hidrófobas, es decir, que escasamente se disuelven en agua, y por el contrario, sustancias con un coeficiente bajo, tienen tendencia hidrófila, es decir que se disuelven bien en agua u otro solvente polar.
Esta característica es estudiada en fármacos, para predecir de qué manera se distribuirá el medicamento en los tejidos. Si su coeficiente de reparto es elevado, tenderá a concentrarse en medios hidrófobos, como por ejemplo la bicapa lipídica de la membrana celular, en cambio si su coeficiente es bajo, tendrá tendencia a distribuirse en entornos hidrófilos, como por ejemplo el plasma sanguíneo.
Suponiendo que tenemos una sustancia soluble en un disolvente X1, y esta misma sustancia es aún más soluble en un segundo disolvente no miscible con X1, que llamaremos X2, podemos extraer la sustancia de X1, agregándole el solvente X2, agitando la mezcla y luego separando las dos fases.
Este proceso se llama extracción, y es muy usado a nivel industrial, para extracción de aceites, grasas y pigmentos.
La extracción nunca será completa, pero se obtienen buenos resultados agregando X2 en fracciones, es decir, agregando un poco de X2, agitando, y luego agregando más X2.
Existen diferentes métodos para medir el coeficiente de reparto. Uno de los más usados es el método del frasco de agitación.

Como se ve en la foto, se colocan las dos fases en un frasco, por ejemplo, octanol y agua, y se disuelve soluto en ellas. Luego se determina la concentración de soluto en cada una de las fases, y se obtiene el coeficiente de reparto.
Existen varios métodos para determinar la concentración del soluto en los distintos disolventes. Las concentraciones se pueden medir por ejemplo por espectroscopía, o añadiendo un trazador radioactivo a la muestra.
El método del frasco de agitación tiene como ventajas que es un método preciso para un amplio rango de solutos, y que no tenemos que conocer previamente la estructura química del soluto para conocer su coeficiente de reparto. Entre las desventajas que presente este método, tenemos que lleva bastante tiempo, y que si la sustancia estudiada es altamente hidrófila o hidrófoba, la concentración en una de las dos fases será muy baja, y por lo tanto difícil de cuantificar con precisión.
Además, para el método del frasco de agitación, la solubilidad debe ser completa, y puede resultar complicado detectar cantidades pequeñas de soluto sin disolver.
