Red iónica
 Por lo general, los aniones son bastante más grandes que los cationes, y por lo tanto, son los aniones los que constituyen un armazón y los cationes, de menor tamaño, van encajando en los huecos (conocidos como intersticios), existentes entre los aniones. Pero antes de comenzar a analizar los diferentes tipos de empaque, tenemos que tener en cuenta ciertos principios generales que se suelen aplicar a las redes iónicas.
Por lo general, los aniones son bastante más grandes que los cationes, y por lo tanto, son los aniones los que constituyen un armazón y los cationes, de menor tamaño, van encajando en los huecos (conocidos como intersticios), existentes entre los aniones. Pero antes de comenzar a analizar los diferentes tipos de empaque, tenemos que tener en cuenta ciertos principios generales que se suelen aplicar a las redes iónicas.
1- Se da por supuesto que los iones son esferas cargadas, incomprensibles y no polarizables. Normalmente existe cierto grado de covalencia en todos los compuestos iónicos; pero no obstante, el modelo de esferas duras parece funcionar bastante bien para la gran parte de los compuestos que se clasifican como iónicos.
2- Los iones tienden a rodearse del mayor número de iones de carga opuesta y de la forma más compacta posible. Dicho principio es particularmente importante en el caso de los cationes. Por lo común, en la disposición de empaque adoptada, el catión es apenas lo suficientemente grande como para permitir que los aniones lo rodeen sin llegar a tocarse unos a los otros.
3- La relación de cationes a aniones debe reflejar la composición química del compuesto. Así por ejemplo, la estructura cristalina del cloruro de calcio, CaCl2, debe consistir de una formación de aniones cloruro con tan sólo la mitad de ese número de cationes calcio en la red cristalina.
Además de estos principios, es importante tener en cuenta que las redes iónicas también son afectadas por otros factores. Por ejemplo, la temperatura y la presión pueden alterar la estructura de la red iónica. A altas temperaturas, los iones pueden obtener suficiente energía para moverse y reorganizarse, lo que puede llevar a una alteración de la estructura de la red. Del mismo modo, la presión puede forzar a los iones a moverse más cerca unos de otros, lo que también puede cambiar la estructura de la red.
Como nombramos en el punto 2, la disposición de empaque que adquiere un compuesto iónico se encuentra determinada por lo normal por el tamaño comparativo de los iones. Gracias al teorema de Pitágoras podemos realizar el cálculo de la relación óptima del radio del catión al radio del anión, el cual es de 0.414. El valor numérico r+/r-, se conoce como relación de radios.
Si el catión es de mayor tamaño que uno que proporcione la relación óptima de 0.414, entonces los aniones se verán obligados a separarse. De hecho, esto es lo que ocurre en la gran parte de los casos, y la mayor distancia anión-anión, reduce la repulsión electrostática entre los aniones. Sin embargo, cuando la relación de radios llega a un valor de 0.732, se hace posible acomodar ocho aniones en torno al catión. A la inversa, si la razón de radios es menor que 0.414, los aniones estarán en contacto estrecho y los cationes parecerán “rebotar”, en la cavidad central. En vez de permitir que esto suceda, los aniones se reacomodan para crear cavidades más pequeñas rodeadas de cuatro aniones de manera única.
Podemos hablar de varios casos de redes iónicas, como puede ser el caso cúbico, el caso octaédrico, o el caso tetraédrico.
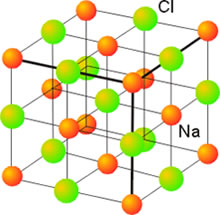
La mejor forma de representar una red iónica es considerar en primer lugar la disposición de los aniones y después examinar el número de coordinación de los intersticios de los armazones de aniones. La única disposición de empaque que posee huecos con ocho aniones alrededor de los mismos, es la forma cúbica simple. Se suele poner como ejemplo clásico el cloruro de cesio, siendo este compuesto el que da su nombre a este tipo de red.
Cuando la relación de los radios es inferior a 0.732, los aniones de la estructura del cloruro de cesio ya no se mantienen separados por los cationes. Las repulsiones potenciales entre los aniones hacen que la geometría octaédrica se convierta en la disposición preferente. Para dicha relación de radios más pequeña, se pueden acomodar seis aniones alrededor de catión sin que se toquen unos a otros. La disposición real de los aniones se basa en la formación compacta cúbica en la cual hay huevos octaédricos y huecos tetraédricos.
En el empaque octaédrico, todos los huecos octaédricos se encuentran ocupados por cationes y todos los huecos tetraédricos se encuentran vacíos. En cambio, los compuestos iónicos en los que los cationes son mucho más pequeños que los aniones se pueden visualizar como armazones compactos de aniones, con los cationes alojados en los huecos tetraédricos.
Es importante mencionar que las redes iónicas también pueden ser afectadas por la presencia de impurezas. Las impurezas pueden alterar la estructura de la red iónica, lo que puede afectar sus propiedades físicas y químicas. Por ejemplo, la presencia de impurezas puede cambiar el color de un cristal iónico, alterar su dureza o cambiar su punto de fusión. Por lo tanto, es esencial controlar la pureza de los compuestos iónicos para asegurar que sus propiedades sean consistentes y predecibles.
