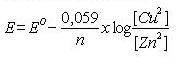Celdas Electroquímicas
Las celdas electroquímicas fueron desarrolladas a finales del siglo XVIII por los científicos Luigi Galvani y Allesandro Volta por lo que también se las denomina celda galvánica o voltaica en su honor.
Una celda electroquímica es un dispositivo experimental por el cual se puede generar electricidad mediante una reacción química (celda Galvánica). O por el contrario, se produce una reacción química al suministrar una energía eléctrica al sistema (celda Electrolítica). Estos procesos electroquímicos son conocidos como “reacciones electroquímicas” o “reacción redox” donde se produce una transferencia de electrones de una sustancia a otra, son reacciones de oxidación-reducción.
La celda electroquímica consta de dos electrodos, sumergidos en sendas disoluciones apropiadas, unidos por un puente salino y conectados por un voltímetro que permite el paso de los electrones.
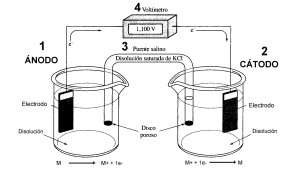
Sus componentes característicos son:
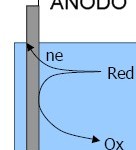
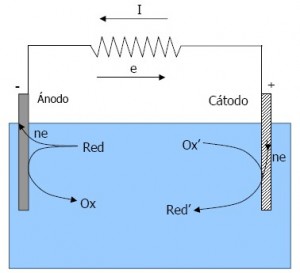
1. Ánodo: Es el electrodo sobre el que se produce la oxidación. El agente reductor pierde electrones y por tanto se oxida.
M ———> M+ + 1e-
Por convenio se define como el polo negativo.
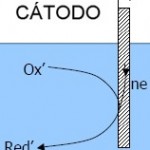
2. Cátodo: Es el electrodo sobre el que se produce la reducción. El agente oxidante gana electrones y por tanto se reduce.
M+ + 1e- ———> M
Por convenio se define como el polo positivo.
3. Puente Salino: Es un Tubo de vidrio relleno de un electrolito que impide la migración rápida de las sustancias de una celda a otra, permitiendo no obstante el contacto eléctrico entre ambas. El electrolito suele ser una disolución saturada de KCl retenida mediante un gel.
4. Voltímetro: Permite el paso de los electrones cerrando el circuito. Mide la diferencia de potencial eléctrico entre el ánodo y el cátodo siendo la lectura el valor del voltaje de la celda.
TIPOS de CELDAS ELECTROQUIMICAS:
1. Celda Galvánica.
• Permite obtener energía eléctrica a partir de un proceso químico
• La reacción química se produce de modo espontáneo
• Son las llamadas pilas voltaicas o baterías.
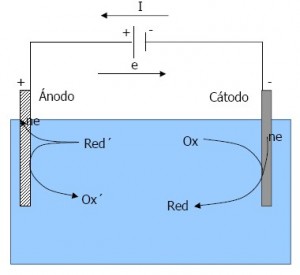
2. Celda electrolítica.
• La reacción no se da de forma espontánea.
• No se obtiene energía eléctrica. La aplicación de una fuente de energía externa produce una reacción química.
CIRCULACIÓN DE LA CORRIENTE:
La electricidad se transporta en una celda a través de 3 mecanismos:
a. Conducción por los electrones en el electrodo.
b. Conducción iónica. Los cationes (cargas positivas) y aniones (cargas negativas) transportan electricidad por el interior de la celda.
c. Acoplamiento de la conducción iónica en la disolución con la conducción de los electrones en los electrodos. Son las reacciones de oxidación-reducción que se producen.
POTENCIAL DE LA CELDA.
La corriente de electrones fluye del ánodo al cátodo porque hay una diferencia de energía potencial entre los dos electrodos. El potencial de la celda o fuerza electromotriz (fem) que aparece reflejado en el voltímetro se obtiene de:
Epila = Ecátodo- Eánodo
Hay que tener en cuenta que no podemos medir los potenciales absolutos, con los instrumentos de medida de voltaje sólo podemos medir diferencia de potencial.
El potencial relativo de un electrodo vendrá dado por:
ERelativo = EElectrodo- EReferencia
Para que los datos puedan ser aplicados de una manera general se refieren a un electrodo de referencia: Electrodo Estándar de Hidrógeno que se le da por convenio el valor de 0,00 voltios.
Se obtiene así una tabla de potenciales estándar EO referidos al electrodo de hidrógeno medidos a temperatura de 25 ºC (298 Kelvin)

Por convenio se define una fem estándar de la celda:
Eopila = Eocátodo- Eoánodo
La diferencia de potencial es una medida de la tendencia que tiene la reacción de transcurrir de un estado de no-equilibrio a un estado de equilibrio.
El potencial de la celda depende de:
• Naturaleza de los Electrodos
• Naturaleza de los Iones
• Concentración
• Y Temperatura
Quedando todos los parámetros reflejados en la ecuación de Nerst:
![]()
EJEMPLO DE CELDA ELECTROQUÍMICA GALVÁNICA: Pila Daniell.
Cátodo: Disolución de CuSO4 (1M) y electrodo de Cu.
![]()
Ánodo: Disolución de de ZnSO4 (1M) y electrodo de Zn.
![]()
Proceso global:
![]()
Eopila = Eocátodo- Eoánodo = 0,34-(-0,763) = 1,103V
Lo que quiere decir que la reacción se da de modo espontáneo.
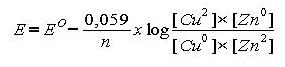
Siendo la concentración de los electrodos, y de las especies sólidas en general, igual a 1M la ecuación quedaría: