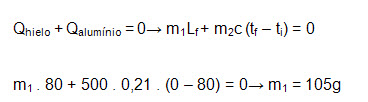El Calor Latente
Sabemos que el calor es energía térmica en tránsito que fluye entre los cuerpos en razón de a diferencia de temperatura entre ellos. De esta forma imaginemos una barra de hierro que recibe o pierde cierta cantidad de calor Q. Ese calor que la barra ganó o perdió se denomina calor sensible, pues el provoca apenas variación en la temperatura del cuerpo, sin que suceda un cambio en su estado de agregación, o sea, si el cuerpo es sólido continúa sólido y lo mismo sucede con los estados líquidos o gaseosos.
Calor Latente
Diferente del calor sensible, cuando ofrecemos energía térmica a una substancia, su temperatura no varía, pero su estado de agregación se modifica, este es el llamado calor latente. Esta magnitud física que informa de la cantidad de energía térmica (calor) que una unidad de masa de una substancia debe perder o recibir para que ella cambie de estado físico, o sea, pase del solido al liquido y del liquido al gaseoso y asi en los demás casos.
El comportamiento de las substancias durante el cambio de fases puede ser interpretado por medio de los siguientes hechos:
1.º hecho = Para pasar de la fase líquida hacia la fase sólida, 1gr de agua necesita perder 80 calorías. De la misma forma para derretir 1gr de hielo precisa ganar 80 calorías
Notemos que 80 calorías representan la cantidad de calor que el agua gana o pierde cuando se derrite o se congela, cuando está a 0°C.
2.º hecho = Si el agua está a 100°C, cada gramo precisa unas 540 calorias para pasar la fase gaseosa a cada gramo de vapor requiere la pérdida de 540 calorías para pasar a la fase líquida.
Otras sustancias también poseen valores fijos de cantidad de calor que 1gr de la substancia requiere ganar o perder para cambiar de una fase a otra.
Esta cantidad de calor se denomina calor latente y se indica a través de la letra L.
El calor latente provoca únicamente un cambio de fase del cuerpo, sin alterar su temperatura.
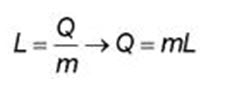
Tenemos que L es el calor latente expresado en calorías/g.
Usaremos:
Lf par el calor latente de la fusión
Lv para el calor latente de la vaporización
Ls para el calor latente de la solidificación
Lc para el calor latente de la condensación
Podemos estandarizar el concepto tomando como:
Calor latente de fusión del hielo (en 0ºC):
Lf = 80 cal/g.
Calor latente de solidificación del agua (a 0°C):
Ls = – 80 cal/g.
Calor latente de la vaporización del agua (a 100°C):
Lv = 540 cal/g.
Calor latente de la condensación del vapor (a 100°C):
Lc = – 540 cal/g.
Algunos ejemplos:
01 – Un bloque de hielo de masa 600 gr se encuentra a 0ºC. Determinamos la cantidad de calor que se debe ofrecer a esta masa para que ella se transforme totalmente en agua a 0ºC. Dado un Lf de 80 cal/g.
Solución:
La cantidad de calor que debemos ofrecer al bloque de hielo para que el se transforme totalmente en agua a 0ºC será:
![]()
02 – Un bloque de aluminio de 500 gr está a una temperatura de 80ºC. Determinamos la masa de hielo a 0ºC que es necesario introducir en contacto con el aluminio para obtenerse un sistema aluminio-agua a 0ºC. Los datos que tenemos son que el calor específico del aluminio es 0,21cal/g°C y el calor latente de fusión del hielo es 80 cal/g .
Solución:
La masa del hielo que se funde provoca la disminución hasta 0ºC del bloque de aluminio así: