Estructura y Estabilidad Química (Termodinámica)
Lo que determina la estructura de un sistema macroscópico
Una molécula de agua, apenas, no es muy interesante: Un átomo de oxígeno, dos de hidrógeno. ¿Qué más se puede decir? Pero si juntamos muchas moléculas de agua… obtenemos copos de nieve, cristales de hielo, nubes, niebla y agua líquida.

Copo de nieve
Un gran número de átomos o de moléculas puede dar origen a casi todo y los físicos lo saben. De hecho, algunos, sueñan con ello. Combinando las moléculas adecuadas, en condiciones apropiadas, es posible diseñar, por ejemplo, aleaciones metálicas ultra resistentes, superconductores a temperatura ambiente y hasta materiales con propiedades que todavía no imaginamos.
La idea de diseñar materiales es excelente, pero hay un problema: las ‘multitudes’ de moléculas, como una multitud de personas, son difíciles de preveer. Apenas en situaciones idealizadas existen reglas simples, como la ley de los gases ideales, para ayudar a los físicos a describir los sistemas con muchas partículas. Las maravillas de los materiales diseñados, sin embargo, están lejos del régimen ideal y las previsiones de este ‘mundo nuevo’ de los físicos han sido difíciles o hasta imposibles.
La Física describe fácilmente el comportamiento de una o dos partículas. Las leyes de Newton, por ejemplo, describen el movimiento de un planeta alrededor del Sol de una manera simple y elegante. Se ahora juntásemos otro planeta, los tres cuerpos (Sol y dos planetas) interactúan entre sí mientras se mueven. La imprevisibilidad del ‘problema de tres cuerpos’ es famosa y son necesarias computadoras y nuevos conceptos para resolver el problema.
Imaginémonos, no tres, pero 10²³ partículas –el número de átomos o de moléculas en una cuchara de sopa de agua. Las partículas interactúan, se enlazan y chocan. El número de interacciones en juego, en cualquier instante, es inimaginable. ¿Cómo podremos predecir la estructura o las propiedades de este sistema?
Una respuesta, a la escala macroscópica, fue dada hace más de doscientos años.
Termodinámica y estabilidad
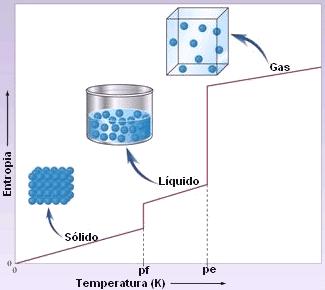
Temperatura y orden molecular
Los sistemas macroscópicos en equilibrio térmico tienen un comportamiento extremadamente simple descrito por las leyes de la Termodinámica. Por ejemplo, la segunda ley, o el principio de la entropía máxima, S, nos dice que el equilibrio de un sistema con volumen constante, a la temperatura T, es determinado por el estado que minimiza la energía libre F,
F = E -TS
Donde E es la energía (suma de la energía cinética y potencial) del sistema. La estabilidad del sólido o del gas se debe a este principio y al hecho de que la materia esté compuesta por átomos.
El sólido cristalino es el estado estable a bajas temperaturas y altas densidades, una vez que la energía es minimizada por el orden molecular –la interacción potencial interatómica tiene un mínimo, para una distancia bien definida, y el cristal se compone de la disposición espacial periódica que minimiza la energía potencial del sistema. De una forma análoga, se concluye que el gas es estable a altas temperaturas y bajas densidades, donde la energía de interacción es despreciable y la entropía es maximizada por el desorden molecular.
Este argumento en general puede ser utilizado para mostrar la existencia de transiciones de fase. Las dos fases, en este caso el sólido cristalino y el gas, tienen simetrías diferentes. En el límite macroscópico, el gas es caracterizado por invariancia de translación continua (todos los pontos son equivalentes del punto de vista de sus propiedades físicas), mientras que el sólido cristalino tiene simetría de translación discreta (los puntos equivalentes son solamente aquellos que están relacionados por un grupo de translación discreto: la red de Bravais). Como el sólido es estable a bijas temperaturas y el gas es estable a altas temperaturas, el sistema tiene necesariamente que exhibir al menos una transición de fase.
¿Qué es una transición de fase?
Los ejemplos de transiciones de fase son comunes: el agua líquida hierve a 100 °C y se congela a 0ºC, a presión de 1 atm. En dichas condiciones, las propiedades físicas del sistema son muy especiales. En particular, las funciones termodinámicas presentan singularidades –Por ejemplo, en la curva de sublimación la densidad pasa discontinuadamente de la densidad típica del sólido a una densidad de alrededor de 1000 veces menor, típica del gas.

Fases del agua y orden molecular
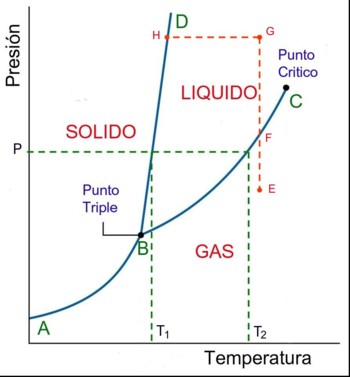
Diagrama de fases del agua
Hay esencialmente dos tipos de transiciones de fase: las continuas y las discontinuas. La transición entre el sólido y el gas es discontinua, porque se trata de calor latente. Cuando una substancia pasa de una fase desordenada (el gas) para una fase ordenada (el sólido), una cantidad de calor (el calor latente) es libertada en el proceso. Esta liberación de calor revela que la estructura del material es alterada de una manera radical. Eso sucede, en particular, a lo largo de las líneas de sublimación, fusión y ebullición de la mayor parte de las substancias conocidas (es a causa de eso que sentimos más calor cuando, a la misma temperatura, estamos en un ambiente más húmedo –en la ducha del baño, ya que el vapor de agua libera una cantidad de calor –el calor latente, al condensarse en nuestra piel).
Los sistemas coloidales (dispersión de partículas esféricas, con rayos del orden de 1 uno, en un solvente) fabricados recientemente presentan una única fase gaseosa (o fluida) y otra sólida, separadas por una línea de sublimación. Sin embargo, la mayor de las substancias naturales es caracterizada por diagramas de fases un poco más complejos y tiene también una fase líquida. A diferencia del sólido y del gas, el líquido es estable en un rango de temperaturas limitadas por el punto triple (donde el sólido, el líquido y el gas coexisten simultáneamente) y por el punto crítico, donde termina la línea de condensación, a lo largo de la cual coexisten una fase líquida y otra gaseosa. El punto crítico entre el líquido y el gas es un ejemplo de una transición de fase continua, o sea, una transición que no implica el calor latente.
