Calor de Reacción y Entalpía
Para simplificar el estudio, dividimos los calores involucrados en las reacciones químicas (ΔH) en grupos, a saber ΔH de combustión, de neutralización, de disolución y de formación.
En todos esos casos, es convención que el valor de ΔH debe ser tomado en condiciones padrón, que son las siguientes:
- Presión de 1 atmósfera
- Temperatura de 25°C o 298 K;
- Sustancias en fase de agregación (sólida, líquida o gaseosa) común en esas condiciones de presión y temperatura.
- Sustancias en la forma alotrópica más estable
Indicamos que el ΔH está en condiciones padrón por la nomenclatura ΔH0 .
ENTALPÍA – ESTANDAR DE COMBUSTIÓN
Se denomina entalpía estándar de combustión a la variación de entalpía (ΔH0) involucrada en la combustión completa de 1 mol de moléculas de determinada sustancia en que todos los participantes de la reacción se encuentran en condiciones estándar.
Ejemplo:
![]()
ENTALPÍA – ESTANDAR DE NEUTRALIZACIÓN
Se denomina entalpía estándar de neutralización a la variación de entalpía (ΔH0) involucrada en la neutralización de 1 equivalente-gramos de un ácido por 1 equivalente-gramos de una base, ambos en soluciones acuosas diluidas.
![]()
Observemos que el ΔH0 de neutralización entre ácidos y bases fuertes es constante. Esto ocurre porque todos los ácidos fuertes y las sales obtenidas por la reacción de estos compuestos se encuentran prácticamente 100% ionizados o disociados en soluciones acuosas líquidas.
ENTALPÍA ESTANDAR DE DISOLUCIÓN
Se denomina entalpía padrón de disolución a la variación de entalpía (ΔH0) involucrada en la disolución de 1 mol de determinada sustancia en una cantidad de agua suficiente para que la solución obtenida sea diluida.
El proceso de disolución de una sustancia en agua se da en dos fases, cada una involucrando respectivamente un ΔH1 y un ΔH2, siendo que: ΔH0 disolución = ΔH1 + ΔH2.
1°) Rompimiento de los enlaces interatómicos en compuestos iónicos o capaces de formar iones intermoleculares en compuestos covalentes. Esta fase es siempre endotérmica
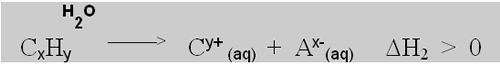
2°) Hidratación de las partículas (iones) del soluto. El involucramiento ordenado de las moléculas de agua alrededor de las partículas (iones) del soluto es siempre un proceso exotérmico
![]()
Así podemos concluir:
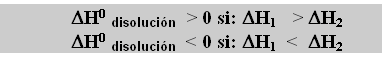
ENTALPÍA ESTÁNDAR DE FORMACIÓN
Se denomina entalpía estándar de formación a la variación de entalpía (ΔH0f ) involucrada en la reacción de formación de 1 mol de moléculas de determinada sustancia, a partir de sustancias simples en condiciones estándar.
Por la propia definición de entalpía estándar de formación concluimos que la entalpía estándar de formación de cualquier sustancia simple en condiciones estándar es igual a cero.

DIFICULTAD DE DETERMINAR EN LA PRÁCTICA EL VALOR DE ΔH
Hay una serie de factores que muchas veces tornan inviable la determinación práctica de variación de entalpía de una reacción. Normalmente el valor de ΔH es medido en aparatos denominados calorímetros pero estos aparatos solo funcionan con precisión para determinados tipos de reacciones.
Otra dificultad que surge en relación a la determinación experimental del ΔH es el propio número de reacciones químicas, que traspasan el ámbito de millones.
Por estos motivos es bastante útil aprender a calcular teóricamente el valor de ΔH y el propio número de reacción química a partir de un conjunto pequeño de informaciones experimentales.
