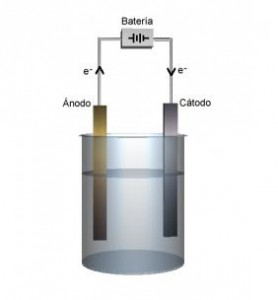
Célula electrolítica
Se le llama célula electrolítica a la celda en la cual se realiza un proceso de electrólisis. En este tipo de procesos, se descompone un electrolito utilizando una corriente eléctrica.
La mayoría de los compuestos inorgánicos y algunos orgánicos, se disocian en iones cuando están en solución, formando electrolitos. Una vez que tenemos el compuesto ionizado, es posible separar los componentes del mismo utilizando una corriente eléctrica. Para este fin es que se utiliza la célula electrolítica, que consta de una celda, cátodo, ánodo y fuente de energía eléctrica.
Entonces, la célula electrolítica funcionaría de la siguiente manera: cuando colocamos los electrodos dentro del electrolito que se quiere descomponer, y aplicamos una corriente eléctrica, los electrones fluirán desde el ánodo hacia el cátodo, de manera que los iones negativos en el electrolito serán atraídos hacia el ánodo, y los iones positivos hacia el cátodo. Cada ión ganará o perderá electrones, según corresponda, y se transformará en un átomo o molécula neutra. De esta manera es posible separar los componentes del electrolito en cuestión.
Un ejemplo sencillo de electrólisis: si disolvemos sulfato de cobre en agua, éste se disociará en cationes cobre con dos cargas positivas y aniones sulfato, con dos cargas negativas. Colocamos esta solución en una célula electrolítica, colocamos los electrodos y aplicamos una diferencia de potencial entre los mismos. Los iones sulfato tenderán a migrar hacia el ánodo (electrodo del cual están saliendo electrones) y descargarán sus electrones allí. Una vez descargados, los iones sulfato son inestables, y se combinan con agua para formar ácido sulfúrico y agua. Los iones cobre migarán hacia el cátodo (electrodo al cual están llegando electrones), se liberarán de su carga y se depositarán sobre el cátodo en forma de átomos de cobre.
En la electrólisis, la cantidad de sustancia obtenida se rige por las leyes de Faraday. Es decir, que la cantidad de sustancia obtenida depende de la cantidad de cargas que han pasado en un determinado tiempo, o dicho de otra manera, el material depositado depende de la cantidad de corriente eléctrica utilizada.
Es importante no confundir una célula electrolítica con una pila galvánica. En el caso de la pila galvánica, una reacción redox ocurre espontáneamente, en dos semiceldas separadas, y la corriente eléctrica generada por la reacción se hace pasar por un circuito externo. En cambio, en la célula electrolítica, la reacción no es espontánea, sino que es inducida por la corriente eléctrica aplicada.
Un ejemplo importante de aplicación del proceso de electrólisis a nivel industrial, es la obtención de cloro e hidróxido de sodio mediante el proceso de electrólisis de la sal común disuelta en agua. En esta reacción, los iones cloro migran hacia el ánodo, cediendo sus electrones y formándose cloro gaseoso. Los iones sodio migran hacia el cátodo, transformándose en átomos de sodio, que se combinan con agua para formar el hidróxido de sodio como subproducto.
El hidróxido de sodio producido de esta manera es utilizado en la fabricación de papel, rayón y película fotográfica, entre otros usos. El cloro producido se usa en la industria de pasta de celulosa y papel.