Reglas de Slater
Las reglas de Slater son un conjunto de reglas de se usan para calcular la carga nuclear efectiva sobre un determinado electrón, en un átomo polielectrónico.
Los electrones causan un efecto de apantallamiento sobre los demás, haciendo que la fuerza de atracción que ejerce el núcleo sobre ellos sea menor. Las reglas de Slater asignan un valor de apantallamiento para cada electrón que forma parte del átomo.
Estos valores, sumados, se restan al número atómico del elemento, y así se obtiene la carga nuclear efectiva sobre el electrón estudiado.
De esta manera tenemos que:
![]()
Siendo Zeff la carga nuclear efectiva, Z el número atómico del elemento y s o S o σ, la constante de apantallamiento, que se obtiene sumando los valores de apantallamiento de cada electrón, según las reglas de Slater.
Estas reglas fueron ideadas por John Slater, en el entorno del año 1930. Slater fue un físico teórico estadounidense que hizo contribuciones significativas a la teoría cuántica. Su trabajo en la teoría de los electrones en los átomos y moléculas proporcionó una base para gran parte de la investigación moderna en la química cuántica.
Lo primero que tenemos que hacer para calcular la constante de apantallamiento según estas reglas, es ubicar los electrones del átomo en los orbitales atómicos correspondientes, 1s, 2s, 2p, 3s, 3p, 3d, etc.
Luego, tenemos que:
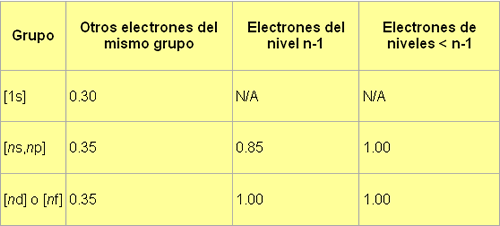
* Cada electrón del mismo grupo que el estudiado aporta 0.35 a la constante de apantallamiento, excepto si se trata del grupo 1s, donde el electrón contribuye con 0.30.
* Si el grupo al que pertenece el electrón estudiado es s o p , cada electrón del grupo inmediato inferior aportará 0.85 a la constante. Electrones de niveles por debajo del inmediato inferior, aportarán 1.00 a la constante.
* Si el grupo al que pertenece el electrón estudiado es d o f , cada electrón de niveles inferiores, todos aportarán 1.00 a la constante de apantallamiento.
A continuación observamos las reglas representadas en la siguiente tabla:
Tomemos por ejemplo, el átomo de hierro, cuyo número atómico es 26. Los electrones de este átomo se disponen en orbitales de la siguiente manera:
1s2, 2s2, 2p6, 3s2, 3p6, 3d6 4s2.
La constante de apantallamiento para uno de los electrones que se encuentra en el nivel 4s, sería la siguiente:
El electrón que se encuentra en el mismo nivel aporta 0.35
Los electrones que se encuentran en los orbitales s y p del nivel 3 aportan 0.85 cada uno.
Los electrones que se encuentran en el orbital d, aportan 0.85 cada uno.
Electrones en niveles 2s , 2p y 1s, aportan 1.0 cada uno.
Entonces, sumando los valores tenemos:
0.35 + (14×0.85) + (10×1) es igual a 22.25
Carga nuclear efectiva para el electrón 4s:
26 – 22.25 es igual a 3,75
Las reglas de Slater son una herramienta esencial en la química cuántica y la física atómica. Permiten a los científicos calcular la carga nuclear efectiva, que es fundamental para entender cómo los electrones interactúan con el núcleo y entre sí. Estos cálculos son cruciales para predecir y explicar el comportamiento de los átomos en una variedad de contextos, desde las reacciones químicas hasta la formación de enlaces químicos y la estructura de las moléculas. Aunque las reglas de Slater son una aproximación, proporcionan una buena primera estimación de la carga nuclear efectiva y son ampliamente utilizadas en la química cuántica y la física atómica.
