Proceso isobárico e isocórico
Los procesos isobárico e isocórico, se encuentran dentro de los procesos termodinámicos que estudia la fisicoquímica, donde se trata la evolución de las magnitudes termodinámicas en un sistema físico concreto.
Dichas magnitudes deben tener bien definidos los estados inicial y final, estudiándose el paso de uno a otro para saber la transformación, cambio u evolución que experimenta la magnitud determinada. Así, los procesos termodinámicos pueden tratarse como el resultado de la interacción de varios sistemas entre sí, con el fin de que entre ellos lleguen a un equilibrio.
Los procesos termodinámicos son cambios en los sistemas, donde las condiciones iniciales cambian debido a una perdida del equilibrio, convirtiéndose en condiciones finales.
Proceso isocórico:
Este proceso es también conocido como isométrico, o isovolumétrico, pues es el proceso termodinámico donde el volumen, en todo momento, permanece constante, ΔV=0, por lo cual no se realiza un trabajo presión-volumen, pues se define a dicho proceso como:
ΔW = PΔV,
- de donde P, hace referencia a la presión.
- W, es el trabajo, que en este caso es positivo, pues es ejercido por el sistema.
- V, es el volumen.
Si aplicamos la primera ley de la termodinámica, o principio de conservación de la energía, que dice que todo sistema termodinámico que se encuentra en estado de equilibrio, posee una variable de estado, denominada energía interna (U), podemos deducir que Q ( variación de energía o calor del sistema, medido en Kcal) para un proceso isocórico es:
Q = ΔU,
lo que refleja que todo el calor que se le transfiere al sistema, queda en el sistema en forma de su energía interna, U.
Si el gas permanece constante, el aumento de energía hará que aumente también la temperatura, por lo que:
Q = nCVΔT,
de donde CV, se refiere al calor específico molar a volumen constante.
En una gráfica, donde representemos presión frente al volumen (P-V), en el proceso isocórico será una línea vertical.
En la siguiente gráfica se representa P-T, donde vemos que a distintos valores de presión y temperatura, se producen distintas líneas isocóricas, todas ellas a igual volumen.
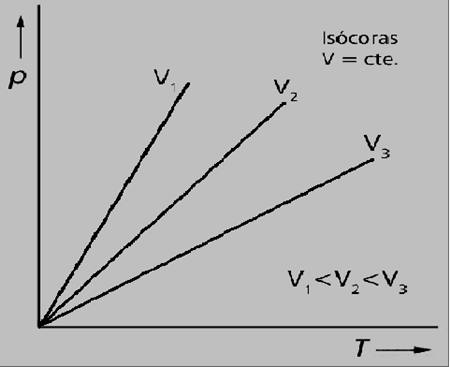
Proceso isobárico:
El proceso isobárico es un proceso que al igual que el anterior, es termodinámico, pero en este caso, es la presión la variable que permanece constante.
En este tipo de procesos, el calor que se transfiere al sistema, con una presión constante, se relaciona con las demás variables a través de la siguiente ecuación:
ΔQ = ΔU + PΔV,
De donde:
Q, es el calor transferido al sistema
U, es la energía interna
P, es la presión (constante en este proceso)
V, es el volumen.
En una gráfica donde representemos presión, frente a volumen (P-V), resultará una línea horizontal.
En cambio, en la siguiente gráfica se representa V frente a T, donde se pueden apreciar diferentes líneas rectas; cada una de ellas refleja a una isobara, donde varían los valores de volumen y temperatura de una a otra.
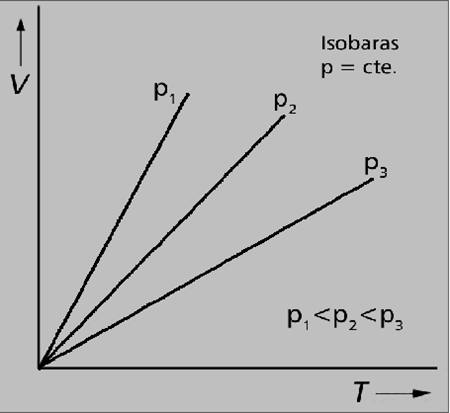
Las líneas isobáricas se utilizan también en la meteorología, para delimitar zonas donde hay diferencia de presión atmosférica o para unir zonas de igual presión.
