Capacidad Calorífica Molar
Un cuerpo al recibir cierta cantidad de energía térmica puede variar su temperatura o su estado físico, o sea, sólido, líquido y gaseoso. La variación de temperatura sucede debido al aumento del movimiento de las partículas constituyentes del cuerpo, en ese caso, la cantidad de calor que el cuerpo recibió es denominada calor sensible. Si por acaso el cuerpo cambia de estado físico a temperatura constante, decimos que la cantidad de calor es denominada calor latente. ¿Pero que viene a ser calor? ¿Cómo se transfiere?
Calor es la energía térmica en tránsito que está determinada por la diferencia de temperatura entre los sistemas involucrados. El calor fluye del cuerpo de mayor temperatura para el cuerpo de menor temperatura y puede ser transferido de un cuerpo al otro de las siguientes maneras:
- Conducción
- Convección
- Irradiación
El término calor es empleado en el sentido de indicar la energía transferida. Indicada por la letra Q la unidad de calor en el Sistema Internacional de Unidades es el joule J, en homenaje al físico ingles James Prescott Joule.
Con todo, la unidad más utilizada es la caloría (cal), sin embargo podemos relacionarla con el joule de la siguiente forma: 1 cal = 4,18 J.
Capacidad Térmica y Calor Específico
Admitiendo que no exista cambio de estado físico, imagine un cuerpo que reciba cierta cantidad de energía y varíe su temperatura. Es denominado como capacidad térmica C, también llamada como capacidad calorífica, o cociente entre la cantidad de calor Q y la variación de temperatura sufrida por el cuerpo (Δt), veamos:
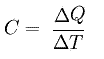
La unidad de capacidad térmica es la caloría por grado Celsius (cal/°C).
Se define como calor específico, también denominado de capacidad térmica, el valor numérico de la cantidad de calor que acarrea una variación de un grado Celsius en un gramo de sustancia.
Matemáticamente definimos como siendo la razón entre la capacidad térmica y la masa del cuerpo.
![]()
La unidad de calor específica es la cal/g.°C.
Ecuación Fundamental de la Calorimetría
Combinando las ecuaciones que definen la capacidad térmica y el calor específico podemos llegar a la ecuación que provee la cantidad de calor sensible intercambiado por el cuerpo de masa m al sufrir una variación en su temperatura.
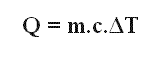
Donde c es el calor específico de la sustancia y ΔT es la variación de temperatura de la sustancia.
Las unidades más usadas de calor específico son:
![]()
Siendo que 1 cal equivale en aproximadamente 4,1855 J.
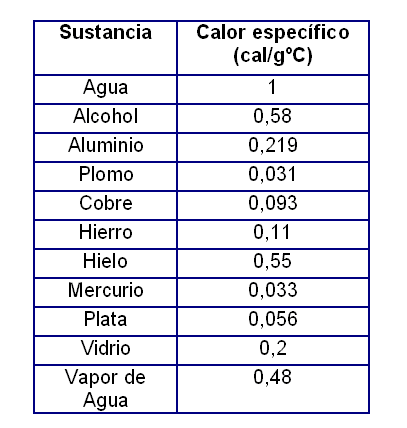
En la tabla a continuación presentamos valores del calor específico de algunas sustancias: