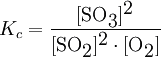Constantes de Equilibrio
Un equilibrio químico es la situación en que la proporción entre las cantidades de reactivos y productos en una reacción química se mantiene constante a lo largo del tiempo. Fue estudiado por primera vez por el químico francés Claude Louis Berthollet en su libro Essai de statique chimique de 1803.
Teóricamente toda reacción química ocurre en los dos sentidos: de reactivos transformándose en productos y de productos transformándose nuevamente en reactivos. Con todo, ciertas reacciones como la de combustión, virtualmente 100% de los reactivos son convertidos en productos y no se observa lo contrario ocurrir (o por lo menos no en escala mensurable); tales reacciones son llamada como irreversibles.
Existe también una serie de reacciones en las cuales enseguida que una cierta cantidad de productos es formada, estos vuelven a dar origen a los reactivos; esas reacciones poseen el nombre de reversibles.
El concepto de equilibrio químico prácticamente se restringe a las reacciones reversibles.
Un ejemplo de reacción reversible es a de producción de amoníaco (NH3), a partir del gas Hidrógeno (H2) y del gas Nitrógeno (N2), que forma parte del proceso de Haber.
N2(g) + 3H2(g) <—-> 2NH3(g)
Constante de Equilibrio
Las constantes de equilibrio reflejan cuantitativamente a los múltiples estados de equilibrio para cada reacción. Son una medida de la mayor o menor extensión de las reacciones químicas.
Una vez alcanzado el equilibrio, la proporción entre los reactivos y los productos no es necesariamente de 1 a 1. Esa proporción es descrita por medio de una relación matemática mostrada a continuación:
Dada una reacción genérica:
aA + bB <—-> yY + zZ ,
donde A, B, Y y Z representan las especies químicas involucradas y a, b, y y z sus respectivos coeficientes estequiométricos. La formula que describe la proporción en equilibrio entre las en equilibrio entre las especies involucradas es:
Los paréntesis representan el valor de la concentración (normalmente en mol/L) de la especie que esta representada dentro de ellos
Kc es un concepto llamado constante de equilibrio de la reacción. Cada reacción de equilibrio posee su constante, la cual siempre posee el mismo valor para una misma temperatura.
De un modo general, la constante de equilibrio de una reacción cualquiera es calculada dividiéndose la multiplicación de las concentraciones de los productos (cada una elevada en su respectivo coeficiente estequiométrico) por la multiplicación de las concentraciones de los reactivos (cada uno elevado en su relativo coeficiente estequiométrico).
Un ejemplo de esto es la formación de trióxido de azufre (SO3) a partir del gas oxígeno (O2) y el dióxido de azufre (SO2(g)), que es una etapa del proceso de fabricación del ácido sulfúrico:
2 SO2(g) + O2(g) <—-> 2 SO3(g)
La constante de equilibrio de esta reacción esta dada por:
Es posible determinar experimentalmente el valor de la constante de equilibrio para una dada temperatura. Por ejemplo, la constante de esta reacción en temperatura de 1000 K es 0,0413 mol/L. A partir de ella, dada una cierta cantidad conocida de productos adicionados inicialmente en un sistema en esa temperatura, es posible calcular por medio de la fórmula de la constante, cual será la concentración de todas las sustancias cuando el equilibrio sea alcanzado.