Clasificación de las Reacciones Químicas
Los fenómenos pueden ser clasificados en químicos (producen nuevas sustancias) y físicos (no producen sustancias nuevas).
A los fenómenos químicos les damos el nombre de: REACCIONES QUÍMICAS
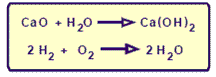
El Oxido de Calcio más agua produce Hidróxido de Calcio. Cuando sustituimos los nombres de las sustancias por sus fórmulas y las palabras por símbolos, obtendremos una: ECUACIÓN QUÍMICA.
![]()
Las sustancias que inician una reacción son los reactivos y constituyen el primer miembro de la ecuación.
En el ejemplo presentado, CaO y H20 son los reactivos y Ca (OH)2 es el producto.
Las ecuaciones químicas poseen fórmulas y coeficientes para mostrar el aspecto cualitativo y cuantitativo de la reacción.
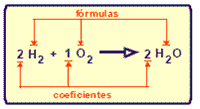
En una reacción química, el número total de átomos de los reactivos es igual al número total de átomos de los productos.
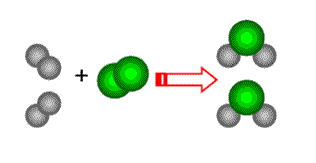
Básicamente podemos clasificar las reacciones químicas en:
a) Reacción de síntesis o adición
b) Reacción de análisis o descomposición
c) Reacción de desplazamiento o simple sustitución
d) Reacción de doble desplazamiento o doble sustitución
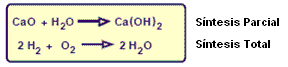
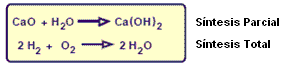
Reacción de Síntesis o Adición
Es cuando una o más sustancias reactivas producen apenas una única.
Si todos los reactivos fuesen sustancias simples la síntesis es total y si tiene por lo menos una sustancia compuesta la síntesis será parcial.
Reacción de Análisis o Descomposición
Es cuando una única sustancia reactiva origina dos o más sustancias como producto
Si en la reacción de análisis fuesen producidas apenas sustancias simples ella será total y si por lo menos uno de los productos fuese una sustancia compuesta ella será parcial.
Las reacciones de análisis pueden recibir nombres particulares, de acuerdo con el agente causante de la reacción.
Pirólisis = descomposión por el calor
Fotolísis = descomposición por la luz
Electrólisis = descomposición por la electricidad
Hidrólisis = descomposición por el agua
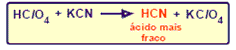
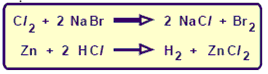
Reacción de desplazamiento o simple sustitución
Son las reacciones en que un elemento químico sustituye otro elemento de un compuesto, liberándolo como sustancia simple.
Algunos ejemplos de estas reacciones son:
Reacción de doble desplazamiento o doble sustitución
Es cuando dos sustancias compuestas intercambian entre si partes de sus estructuras.
Un ejemplo puede ser:
![]()
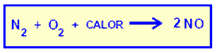
Las reacciones que presentan elementos químicos sufriendo oxidación o reducción son denominadas como reacciones de reducción-oxidación u oxi-reducción.
![]()
El fósforo sufre oxidación y el nitrógeno sufre reducción
Las reacciones químicas en cuanto al calor involucrado, pueden ser clasificadas en:
ENDOTÉRMICAS
Son aquellas reacciones que ocurren absorbiendo calor externo
EXOTÉRMICAS
Son aquellas reacciones que ocurren liberando calor para el medio ambiente.

Podemos también clasificar las reacciones en reversibles e irreversibles.
REACCIONES O PROCESOS REVERSIBLES
Son reacciones o procesos en que reactivos y productos son consumidos y producidos al mismo tiempo. Los reactivos y productos de estas reacciones son separados por una flecha doble.
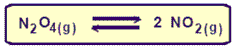
La reacción que ocurre de la izquierda para la derecha se llama REACCIÓN DIRECTA; mientras que la que ocurre de la derecha para la izquierda se llama REACCION INVERSA.
Reacciones o procesos irreversibles
Son reacciones o procesos que ocurren en un único sentido.

Condiciones para la existencia de algunas reacciones
REACCIONES DE DESPLAZAMIENTO
Las reacciones de desplazamiento ocurren cuando el elemento que sustituye otro, de la sustancia compuesta, es más reactivo.
![]()
El zinc es más reactivo que el hidrógeno. El orden de reactividad de los principales metales es observada en la tabla que sigue:
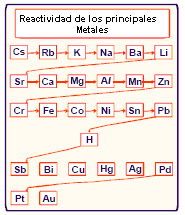
![]()
El cloro es más reactivo que el bromo. El orden de reactividad de los principales no metales es presentado en la tabla que sigue:
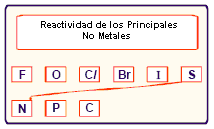
Reacciones de doble desplazamiento
Algunas condiciones para que ocurra una reacción de doble desplazamiento son:
- Formación de un precipitado
![]()
- Formación de una sustancia volátil
- Formación de una sustancia más débil (menos ionizada o disociada)