Entropía Termodinámica
Antes de comenzar a describir las distintas acepciones de la palabra entropía en el área de la termodinámica, primero tendremos que repasar algunas definiciones.
La termodinámica es la disciplina que estudia los cambios de energía interna en los sistemas, y los intercambios de energía entre los distintos sistemas.
Esta disciplina se apoya sobre la base de algunas leyes, que describiremos brevemente a continuación.
Ley cero: esta ley termodinámica nos indica que si suponemos la existencia de dos cuerpos, con distintas temperaturas, y ponemos sus superficies en contacto, cuando haya transcurrido un cierto tiempo, la temperatura de ambos cuerpos se habrá igualado. El más frío habrá aumentado su temperatura, y el más caliente se habrá enfriado, gracias a la transferencia de energía en forma de calor de uno a otro.
Primera ley termodinámica: esta ley indica que si tenemos un sistema que tiene una determinada cantidad de energía interna y llevamos a cabo un trabajo sobre él, mediante algún tipo de proceso, o le brindamos calor al sistema, la energía interna dicho sistema variará. Por ejemplo, si el sistema es una vasija de metal con agua fría, podemos variar la energía interna del mismo: si revolvemos el agua con un elemento tal como una cuchara, podemos elevar la temperatura de la misma por fricción: estamos realizando un trabajo que variará la energía interna del sistema. Si calentemos el agua con un mechero, le estamos aportando calor al sistema, hecho que variará también su energía interna.
La energía interna de un sistema, el calor y el trabajo, son sólo distintas formas de energía. No es posible crear o destruir energía, sólo es posible transformar una forma de energía en otra.
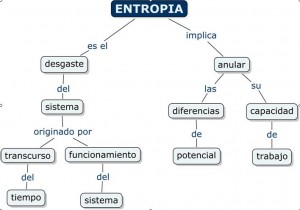
Segunda ley termodinámica: según esta ley, no existe ningún proceso en el cual se pueda aprovechar toda la energía para transformarla en trabajo. En cualquier proceso, una parte de la energía se transformará a formas no convertibles en trabajo.
Basado en este principio, Clausius definió la entropía como la medida de las restricciones para que un determinado proceso sea realizado, y también nos indica la dirección del proceso.
La entropía como grado de desorden o desorganización.
Imaginemos que existe una caja dividida internamente en tres sectores, y en cada sector hay bolitas de distintos colores. En el primer sector, bolitas negras, en el segundo blancas y en el último, rojas.
Si quito una de las divisiones internas de la caja, las bolitas negras y blancas se mezclarán. Si quito la segunda división, todas las bolitas se mezclarán. Al quitar divisiones, estoy quitando restricciones, y el desorden o la entropía del sistema ha ido aumentando.
Si vuelvo a colocar las divisiones, las bolitas continuarán desordenadas, porque no se ordenarán espontáneamente. Esto indica que el proceso es irreversible.
En la naturaleza, todos los procesos son irreversibles, los sistemas siempre tienden a aumentar su entropía, es decir, su grado de desorganización.
Otro ejemplo podría ser una copa de vidrio, que tiene cierta entropía. Cuando la copa se cae al suelo, se rompe en varios pedazos, aumentando su entropía. El proceso es irreversible, ya que aunque juntemos los pedazos, jamás se volverá a formar la copa por sí sola.
Es importante indicar que únicamente tiene sentido hablar de entropía cuando hay una variación de la misma. No existe la entropía de un sistema como valor absoluto, sino sólo como variación de entropía final menos inicial (delta S).
La entropía como energía «perdida».
Según el principio de Clausius, la entropía es la energía que se libera en un proceso. Si ponemos por ejemplo un motor, la gasolina sufre un proceso de combustión y la energía liberada hace que el coche se mueva. La energía que fue “usada” por el coche para moverse, se “gastó” y ya no puede utilizarse para producir trabajo.
