Teoría Ácido-Base de Brönsted-Lowry
La deficiencia en la definición de Arrhenius, o sea, el hecho de una sustancia ser ácida o básica solamente en un medio acuoso, provocó el estudio y surgimiento de nuevas definiciones y teorías para los ácidos y las bases.
Es así que en 1923, J. N. Brönsted e T. M. Lowry, independientemente, en Dinamarca e Inglaterra, respectivamente, propusieron una definición mas amplia y genérica para ácidos y bases. La llamada hoy día definición protónica.
La definición protónica define un ácido, como toda sustancia (moléula o ión) capaz de liberar un protón (H+), y una base, como toda sustancia (molécula o ión) capaz de recibir un protón.
Esta definición es mucho más amplia que la de Arrhenius, una vez que el medio de reacción no influye en la propiedad de ser o no un ácido o una base. Un ejemplo de ello es el H2SO4 (ácido sulfúrico) que en un medio acuoso libera iones H+ y en ácido acético como solvente, también libera iones H+. Ya el NaOH (hidróxido de sodio), en medio acuoso, libera iones OH-, entretanto, en ácido acético como solvente, ocurre la formación de acetato de sodio, que actúa como base.
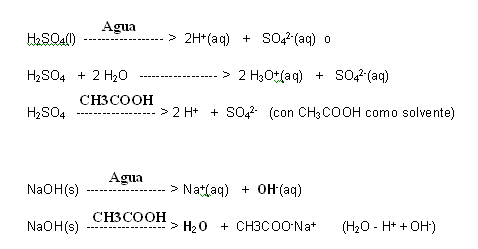
Siendo así, la liberación de OH- no es una característica de todas las bases, mas la capacidad de recibir un protón, si lo es.
Por la definición de Bronsted-Lowry, no es necesario ni siquiera un medio húmedo para que las reacciones ocurran. La reacción entre vapores de ácido clorhídrico y amoníaco es un ejemplo de ello. El cloruro de amonio es el producto sólido de esta reacción.
Según la definición protónica, una reacción ácido-base involucra la competición de un protón (H+) entre dos bases.
H2SO4 + 2 H2O —————— > 2 H3O+(aq) + SO42-(aq)
(ácido 1) (base 2) (ácido 2) (base 1)
Un ácido (ácido 1) al reaccionar con una base (base 2), siempre va a originar una base debil (base 1) y un ácido débil (ácido 2). Formandose pares de ácido y base conjugados.
ácido 1 —————— > base 1
base 2 —————— > ácido 2
