Ley de los gases reales
Un gas real se define como un gas con un comportamiento termodinámico que no sigue la ecuación de estado de los gases ideales.
Un gas puede ser considerado como real, a elevadas presiones y bajas temperaturas, es decir, con valores de densidad bastante grandes. Bajo la teoría cinética de los gases, el comportamiento de un gas ideal se debe básicamente a dos hipótesis:
– las moléculas de los gases no son puntuales.
– La energía de interacción no es despreciable.
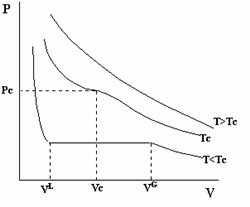
La representación gráfica del comportamiento de un sistema gas-líquido, de la misma sustancia, se conoce como diagrama de Andrews. En dicha gráfica se representa el plano de la presión frente al volumen, conocido como plano de Clapeyron.
Se considera a un gas encerrado en un cilindro con un embolo móvil. Si el gas se considera ideal, se mantiene la temperatura constante, obteniendo en el plano de Clapeyron líneas isotermas, es decir, líneas hiperbólicas que siguen la ecuación:
p.V= cte.
Si en cambio, consideramos a un gas como real, veremos que solamente con la temperatura bastante alta y la presión bastante baja, las isotermas se acercan a las hipérbolas, siguiendo la ecuación de estado de los gases perfectos.
Potencial de Lennard Jones:
Siguiendo una observación experimental, vemos una importante diferencia entre el comportamiento de los gases reales e ideales. La distinción primordial es el hecho de que a un gas real no se le puede comprimir indefinidamente, no siguiendo así la hipótesis del gas ideal. Las moléculas ocupan un volumen, pero los gases reales son, a bajas presiones más comprimibles que un gas ideal en las mismas circunstancias, en cambio, son menos comprimibles cuando tienen valores de presión más elevadas. Este comportamiento depende mucho de la temperatura y del tipo de gas que sea.
El comportamiento de estos gases, puede ser explicado debido a la presencia de fuerzas intermoleculares, que cuando tienen valores de temperatura pequeños, son fuertemente repulsivas, y en cambio, a temperaturas altas, son débilmente atrayentes.
La ley física de los gases reales, también conocida como ley de Van der Waals, describe el comportamiento de los gases reales, tratándose de una extensión de la ley de los gases ideales, mejorando la descripción del estado gaseoso para presiones altas y próximas al punto de ebullición.
La ley de los gases reales, toma el nombre del físico holandés Van der Waals, el cual propone su trabajo de los gases en 1873, ganando un premio Nobel en 1910 por la formulación de ésta ley.
La ley de Van der Waals e una ecuación de estado a partir de la ley de los gases ideales :
p.V = n.R.T
El físico holandés, introduce dos valores, asignándoles las letras a y b, conocidas como constantes de Van der Waals, que depende de la sustancia que se esté estudiando en cada caso.
La fórmula de la ley de Van der Waals, es:
( p + a. n^2 / V^2 ) . ( V – nb) = nRT
De donde p, hace referencia a la presion del gas.
n= cantidad de sustancia ( número de moles)
V= volumen ocupado por el gas
R= constante universal de los gases
T= temperatura en valor absoluto.
Los valores de las costantes de Van der Waals para los gases mñas comunes, están recogidos en tablas.
Si comparamos la ley de Van der Waals con la ley de los gases ideales, cuando la presión de un gas no es demasiado alta, el modelo de Van der Waals puede decirse que su modelo y el de los gases ideales no difieren mucho.
La ley de Van der Waals también permite entender bien los procesos de condensación de los gases, existiendo para casa gas una temperatura, Tc, conocida como temperatura critica, la cual representa la frontera del paso a la condensación:
- para T > Tc, no se puede condensar el gas.
- Para T< Tc, es posible condensar el gas si éste se comprime a una presión adecuada, que es más baja cuanto más baja es la temperatura.