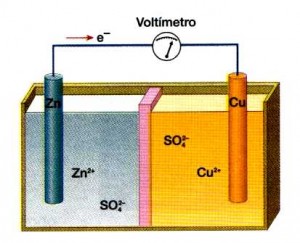
Equilibrio Redox
(Abreviatura de oxidación-reducción) Las reacciones redox engloban a todas las reacciones químicas en las que los átomos tienen su número de oxidación (estado de oxidación) cambiado.
Esto puede ser un proceso redox simple, tal como la oxidación del carbono para producir dióxido de carbono (CO 2) o la reducción de carbono en el hidrógeno para producir metano (CH 4), o un proceso complejo, como la oxidación del azúcar (C 6 H 12 O 6) en el cuerpo humano a través de una serie de complejos de transferencia de electrones procesos.
El término viene de los dos conceptos de ucción rojo y idation buey. Se puede explicar en términos simples:
La oxidación es la pérdida de electrones o un aumento en el estado de oxidación de una molécula, átomo o ion.
La reducción es la ganancia de electrones o una disminución en el estado de oxidación de una molécula, átomo o ion.
Aunque es suficiente para muchos propósitos, estas descripciones no son precisamente correctas. La oxidación y la reducción correctamente se refieren a un cambio en el número de oxidación – la transferencia real de electrones no puede ocurrir. Por lo tanto, la oxidación es mejor definida como un aumento en el número de oxidación y reducción como una disminución en el número de oxidación. En la práctica, la transferencia de electrones siempre causará un cambio en el número de oxidación, pero hay muchas reacciones que se clasifican como «redox» aun cuando no se produce transferencia de electrones (como las relacionadas con covalente bonos).
-Reacciones redox no, que no implican cambios en la acusación formal, que se conoce como metátesis de reacciones.
Oxidantes
Los oxidantes son normalmente elementos químicos o sustancias con elementos en el número de oxidación (por ejemplo, H 2 O 2 , MnO -4 , CrO 3 ,Cr 2 O 2 a7 , OsO 4 )sustancias o elementos que pueden tener uno o dos electrones adicionales por oxidación de un elemento o sustancia ( S , F , Cl , Br ).
Reductores
Las sustancias que tienen la capacidad de reducir otras sustancias se dice que son reductora y son conocidos como agentes reductores, reductores, o reductoras.
Es decir, los electrones transfieren reductores a otra sustancia, y por lo tanto se oxida. Ya que «dona» los electrones, que también se conocen como donador de electrones. Los donantes de electrones también pueden formar complejos de transferencia de carga con receptores de electrones.
Los reductores de la química son muy diversos. Electropositivos elemental de metales, tales como litio, sodio, magnesio, hierro, zinc, aluminio, carbono, son buenos agentes reductores.
Estos metales donan o ceden electrones fácilmente. Transferencia de hidruro de reactivos, tales como NaBH4 y LiAlH4, son ampliamente utilizadas en química orgánica, principalmente en la reducción de carbonilo compuestos de alcoholes.
Otro método de reducción consiste en el uso de gas de hidrógeno (H 2), con el paladio, el platino o níquel catalizador. Estas reducciones catalíticas se utilizan principalmente en la reducción de carbono-carbono o el triple de dobles enlaces.