Descubrimiento del núcleo
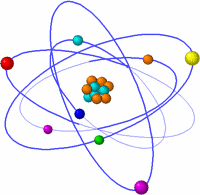 En 1909 fue reemplazado el modelo atómico de Thomson, por un antiguo alumno suyo, Ernest Rutherford, el cual descubrió que la gran parte de la masa del átomo, así como su carga positiva, se encontraba concentrada en el centro de su volumen total, prediciendo que dicha fracción se encontraba en el centro.
En 1909 fue reemplazado el modelo atómico de Thomson, por un antiguo alumno suyo, Ernest Rutherford, el cual descubrió que la gran parte de la masa del átomo, así como su carga positiva, se encontraba concentrada en el centro de su volumen total, prediciendo que dicha fracción se encontraba en el centro.
Fue en 1911, cuando Hans Geiger y Ernest Marsden, bajo la supervisión de Ernest Rutherford, realizaron un experimento conjunto en cual consistía en lanzar partículas alfa (núcleos ionizados de helio-4, que están formados por dos neutrote soy dos protones) procedentes de una fuente radiactiva, contra una lámina de oro. Estas partículas chocaban contra una pantalla fluorescente que estaba colocada alrededor de la lámina del metal.
Estos científicos, siguiendo el modelo de Thomson, y considerando el momento de las partículas alfa y tomando como mínima la masa de los electrones, esperaban que el resultado de su experimento fuese, que todas las partículas alfa atravesasen la lámina de oro sin torcer su trayectoria, o en su defecto, que dichas partículas fuesen absorbidas por la lámina, sin embargo, se asombraron al ver que una pequeña cantidad de partículas alfa fueron desviadas de su trayectoria, no siguiendo sus predicciones.
Fue así como Rutherford, siguiendo los resultados del experimento de “la lámina de oro”, propuso su modelo atómico, destituyendo al modelo de Thomson, que imperaba hasta aquel momento. En éste modelo, los electrones giraban entorno al núcleo, esa nueva parte del átomo. Esta propuesta simulaba al sistema planetario.
Gracias al experimento de la lámina de oro, Rutherford demostró que los átomos estaban prácticamente vacíos, concentrando la mayor parte de su masa en la parte central, es decir, en el núcleo. Dedujo que la gran parte del átomo estaba vacío debido a que la gran mayoría de las partículas proyectadas seguían una línea recta, y una cierta cantidad de partículas se desviaban, indicando la existencia de un núcleo. Es así como se le atribuye a este físico alemán el descubrimiento del núcleo.
El núcleo, parte central del átomo, es donde se encuentra concentrada el 99,9 % de la masa total aproximadamente, atribuyéndosele carga positiva. Se encuentra constituido por neutrones y protones (la suma de estos se conoce como nucleones), unidos por interacciones nucleares.
Las partículas constituyentes del núcleo son los protones y los neutrones:
- Los protones son partículas subatómicas, cargadas positivamente. El número de protones de cada átomo, indica la posición del elemento en la tabla periódica, ya que coincide con el número atómico, representado por la letra Z. Los núcleos que poseen igual Z, se les conoce con el nombre de isótopos. El descubrimiento de estas partículas se atribuye a J.J.Thomson.
- Los neutrones, son bariones, es decir, partículas subatómicas constituidas por tres quarks. Estas partículas cuando están fuera del núcleo (el cual comparte con los protones), son inestables, con una vida media de apenas minutos, pudiendo llegar a convertirse en protón, al emitir un electrón y un antineutrino. La masa de los neutrones es muy similar a la de los protones. Gracias a su presencia los núcleos tienen estabilidad. Fue en 1920, cuando Rutherford propuso la existencia de esta partícula, pudiendo explicar así que los núcleos no se separasen debido a la repulsión electromagnética que ejercían los protones.
