Ley de Guldberg Waage – Acción de Masas
La dinámica de las reacciones entre sustancias no puede ser comprendida sin el concepto de equilibrio químico. No importa si en términos de transferencia de electrones (equilibrio de oxidación y reducción), del intercambio de cargas eléctricas (equilibrio iónico) o de procesos de otra naturaleza, la situación de equilibrio químico determina la estabilidad a la que tiende toda reacción.
Equilibrio químico es un fenómeno que ocurre cuando, en condiciones definidas de temperatura y presión, las velocidades de una reacción química reversible se igualan en los dos sentidos. En ese punto, las concentraciones de todas las sustancias presentes en el sistema permanecen constantes, a pesar de continuar procesándose la reacción, motivo por el cual el hecho también es denominado equilibrio dinámico.
Evolución de una reacción química. La interacción de dos o más sustancias suscita el desarrollo de una reacción química cuando, en condiciones favorables, los átomos o moléculas de esas sustancias presentan una cantidad de energía adecuada, denominada energía de activación.
Esta última se relaciona con la magnitud del aumento de energía interna asociada a las partículas es responsable por la ocurrencia de la reacción.
Así, el contacto de una molécula de cloro, Cl2, con una molécula de hidrógeno, H2, resulta en la formación de dos unidades moleculares de ácido clorhídrico, HCl, según la reacción.
Como en toda reacción reversible, esto es, que ocurre tanto en un sentido de formación de producto cuanto en la formación de los reactivos a partir del producto, en ese proceso las concentraciones de los reactivos disminuyen progresivamente, hasta llegar a una situación de equilibrio, en que las velocidades de las reacciones en los dos sentidos son iguales.
En ese instante, el sistema reactivo es constituido por una mezcla de ácido clorhídrico, cloro e hidrógeno. El estudio de las condiciones de equilibrio químico se basa en criterios fundamentalmente dinámicos, una vez que, alcanzadas estas condiciones, las reacciones ocurren en ambos sentidos, simultáneamente y sin interrupciones.
LEY DE LA ACCIÓN DE LAS MASAS
Ley de la Acción de las Masas. Uno de los principios básicos a partir de los cuales se desarrollo el concepto de equilibrio químico es la llamada ley de acción de las masas, enunciada por los químicos noruegos Cato Maximiliam Guldberg y Peter Waage, en 1866.
La expresión matemática de la ley de acción de masas está dada por:
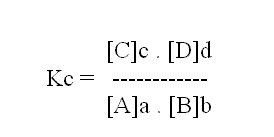
Donde las concentraciones molares de cada sustancia son representadas entre corchetes y Kc es la llamada constante de equilibrio. Se puede interpretar esta ley en términos de las velocidades de reacción (v) a través de las siguientes expresiones:
![]()
Donde k1 y k2 son constantes de velocidad referentes a las reacciones de formación y de descomposición del producto, respectivamente. En esos términos, la constante de equilibrio Kc es equivalente al cociente de las constantes de velocidad (Kc = k1/k2).
En la expresión matemática de la constante de equilibrio, las concentraciones molares de los productos de la reacción están en el numerador, en cuanto a las relativas a los reactivos se sitúan en el denominador.
Consecuentemente, cuando esa constante tuviese valor elevado habrá fuerte tendencia a la formación de productos, motivo por el cual se dice que el equilibrio está trasladado en el sentido de la derecha. Inversamente, cuando el valor de Kc fuese bajo, la reacción ocurre, de preferencia, en el sentido de izquierda, esto es, de la descomposición del producto, o formación de los reactivos.
Leyes de traslado del equilibrio. El traslado de las condiciones de equilibrio es regido por dos principios básicos, enunciados por el holandés Jacobus Henricus van»t Hoff y por el francés Henry-Louis Le Chatelier.
La ley de Van»t Hoff provee interesantes conclusiones en cuanto al comportamiento del equilibrio químico en fase del cambio de temperatura. Si la reacción es exotérmica ( que libera calor), el aumento de temperatura lleva a la disminución de la constante de equilibrio. El equilibrio es entonces trasladado en el sentido de los reactivos, o sea, en el sentido de la reacción opuesta, que es endotérmica (que absorbe calor), el aumento de temperatura lleva al traslado del equilibrio en el sentido de los productos, pues la constante de equilibrio crece.
Ese comportamiento es el caso particular de un principio general, el de Le Chatelier: “en un sistema en equilibrio químico, la modificación de cualquier coordenada intensiva, cuyo valor no depende de la cantidad de sustancia, provoca en el equilibrio un cambio que tiende a anular tal modificación”. En otras palabras, en la reacción química, el aumento de temperatura mediante el abastecimiento de calor, traslada el equilibrio en el sentido en que exista absorción de calor. De la misma forma, si existe aumento de presión, el sistema reactivo se modifica, favoreciendo el integrante de la reacción que ocupe menos volumen.
Analizándose la reacción de síntesis y descomposición de la molécula de agua, si la temperatura es reducida, la reacción tiende a oponerse a ese enfriamiento, siendo entonces el equilibrio trasladado hacia la derecha, lo que provoca liberación de calor.
Por otra parte, un aumento de temperatura causa el traslado del equilibrio para la izquierda, en el sentido de descomposición del agua y absorción de calor.
Diferenciación de los equilibrios químicos. Las leyes generales del equilibrio son válidas también para los procesos de reacción entre ácidos y bases, así como en los procesos de oxidación-reducción, en que la reacción se debe a la perdida o ganancia de electrones, respectivamente.
Otro grupo de reacciones químicas que son regidas por las leyes del equilibrio son las de precipitación, a través de las cuales se da la formación de sustancias sólidas a partir de una solución. También obedecen a las leyes de equilibrio las reacciones que involucran compuestos de coordinación, sustancias constituidas por moléculas integradas por un átomo central, generalmente un metal de transición, que forman un grupo aislado de compuestos químicos con propiedades distintas.
Por fin, el concepto de equilibrio químico es aplicable a las reacciones de formación y descomposición de compuestos iónicos y la modificación del estado de agregación de una sustancia, a la que también se da el nombre de cambio de fase.
