Indicador redox
Un indicador redox es una sustancia cuyo color es intenso, bien definido, y distinto en sus estados oxidado y reducido. Se utilizan como indicador en las titulaciones redox, ya que estas sustancias requieren sólo un ligero cambio en la proporción de un estado u otro, para variar de color, y no alteran significativamente el titulante, ya que el color se puede apreciar aún cuando la concentración del indicador es baja. Entonces, cuando se ha llegado al punto de equivalencia, una sola gota más del titulante hará variar al indicador.
Los indicadores redox son esenciales en los procesos de titulación redox, ya que permiten determinar el punto final de la reacción, es decir, el momento en el que todos los reactivos se han consumido. Esto es especialmente importante en las reacciones químicas en las que se busca determinar la concentración de una sustancia desconocida, ya que permite calcular con precisión la cantidad de sustancia presente.
En la siguiente tabla tenemos una lista de algunos indicadores redox, y sus respectivos colores en forma reducida y oxidada:
| Indicador | Color Reducido | Color Oxidado |
| Azul de Metileno | Azul | Incoloro |
| Difenillamin-Sulfato de Bario | Incoloro | Púrpura |
| Nitro-Ferroina | Rojo | Azul-Pálido |
| Rojo neutro | Rojo | Incoloro |
| Tionina | Violeta | Incoloro |
| Ferroina | Rojo | Azul-Pálido |
Es importante mencionar que la elección del indicador redox adecuado depende de varios factores. Entre ellos, el tipo de reacción redox que se está llevando a cabo, las condiciones de la reacción (como la temperatura y el pH), y las propiedades específicas del indicador, como su rango de cambio de color y su sensibilidad a los cambios en la concentración de los reactivos.
Algunas sustancias sirven como indicadores internos. Por ejemplo, el permanganato de potasio puede ser usado como oxidante y como indicador redox al mismo tiempo. Esta sustancia tiene un color rosa pálido cuando está reducido, y un color violeta fuerte cuando está oxidado. De manera que cuando titulamos con permanganato de potasio, la primera gota en exceso de oxidante, causará la aparición de este color violeta, indicando el final de la titulación.
Otros indicadores son específicos, son indicadores que reaccionan específicamente con uno de los reactivos, por ejemplo el almidón, que produce un color azul intenso cuando reacciona con el iodo, o el ion tiocianato, que reacciona con el hierro (III) produciendo un color rojo.
La reacción de un indicador redox en una volumetría redox, podría representarse de la siguiente manera:
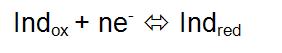
Cuando el indicador es adicionado a la mezcla que está siendo titulada, la relación entre la concentración del indicador reducido y la concentración del indicador en su forma oxidada, se ajustan de tal manera que en todos los puntos de la titulación, el potencial del indicador se ajusta al potencial de la mezcla.

