Indicadores ácido –base
 Desde tiempos muy antiguos, se conocen distintas sustancias de origen orgánico que tienen la propiedad de cambiar su color, dependiendo de las características ácidas o básicas de las sustancias a las que son añadidas. En la actualidad, estas sustancias, y muchas otras, que se han introducido en el uso habitual de los laboratorios químicos, se utilizan con la finalidad de determinar el valor del pH de las disoluciones, así como también, el punto final de las valoraciones ácido –base. Dichas sustancias reciben el nombre de indicadores ácido-base.
Desde tiempos muy antiguos, se conocen distintas sustancias de origen orgánico que tienen la propiedad de cambiar su color, dependiendo de las características ácidas o básicas de las sustancias a las que son añadidas. En la actualidad, estas sustancias, y muchas otras, que se han introducido en el uso habitual de los laboratorios químicos, se utilizan con la finalidad de determinar el valor del pH de las disoluciones, así como también, el punto final de las valoraciones ácido –base. Dichas sustancias reciben el nombre de indicadores ácido-base.
Así podemos definir a un indicador ácido-base como, una sustancia que puede ser de carácter ácido o básico débil, que posee la propiedad de presentar coloraciones diferentes dependiendo del pH de la disolución en la que dicha sustancia se encuentre diluida.
Los indicadores presentan un comportamiento muy sencillo de comprender. Para realizar los ejemplos, supongamos a un indicador que está constituido por un ácido débil monoprótico con formula general Hln, de este modo, en una disolución acuosa se ionizará débilmente produciendo la base conjugada correspondiente ln^-.
Hln + H2O ↔ H3O^+ + ln^-
Fórmula ácida Fórmula básica
(Amarilla) (Azul)
Una característica de los indicadores es que la forma ácida (Hln) y la forma básica (ln^), tienen colores diferentes, por ejemplo, amarillo y azul, como en el caso de nuestro ejemplo. De las cantidades de una u otra forma que se encuentran presentes en la disolución, es de lo que depende el color de ésta.
Si se le añade a una disolución ácida HA, una pequeña cantidad de la disolución indicadora, se producen al mismo tiempo dos procesos, el equilibrio de ionización del indicador, y también el del ácido.
Hln + H2O ↔ H3O^+ + ln^-
HA + H2O ↔ H3O^+ + A^-
Cuando aumenta la concentración de [H3O^+], por efecto del ión común, el equilibrio que tiene el indicador se desplaza a la izquierda. En consecuencia, el color que predomina en la disolución será el color de la forma ácida, Hln.
Si añadimos una pequeña cantidad de indicador a una disolución básica:
Hln + H2O ↔ H3O^+ + ln^-
B + H2O ↔ BH^+ + OH^-
La concentración [H3O^+], se verá disminuida por la combinación de los iones H3O^+, con los iones OH^-, Y el equilibrio del indicador se ve afectado, desplazándose hacia la derecha. En consecuencia, dominará en la disolución el color de la forma básica ln^-
Cada uno de los indicadores posee un intervalo de viraje que lo caracteriza, es decir, un entorno en mayor o menor medida, reducido de unidades de pH. Dentro de dicho intervalo es donde se produce el cambio de color, o viraje. Un indicador tiene mayor utilidad, cuanto más pequeño es su intervalo de viraje, produciéndose así de forma más clara y sencilla el cambio de color.
En la tabla siguiente se muestran algunas indicadores ácidos-base, junto a los datos de sus intervalos de viraje y el color que tienen cuando el pH es menor o superior, a dicho intervalo.
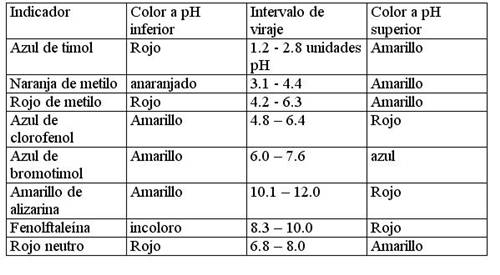
Ejemplo:
Pongamos como ejemplo el comportamiento del indicador azul de bromotimol, en tres soluciones diferentes: la solución ácida, neutra y básica.
- Al añadir nuestro indicador azul de bromotimol, en un tubo de ensayo que contenga una disolución de HCl por ejemplo, veremos un color amarillo en la solución, que tendrá un pH < 6.0.
- Si añadimos el mismo indicador a otro tubo de ensayo, esta vez relleno de agua, veremos que tendrá una coloración verde, con un pH= 7.
- Por último, cuando añadimos el indicador de azul de bromotimol, a un tubo de ensayo que contenga una disolución de NaOH, veremos como ésta se tiñe de azul, con un pH > 7.6. Se comprueba de este modo que el intervalo de viraje está entre 6.0 y 7.6.
El papel indicador universal, es gran utilidad en los laboratorios para poder medir de manera muy sencilla los diferentes pH de las disoluciones. Su manejo es extremadamente sencillo, pues basta con introducir un trocito de papel en la disolución problema, y éste inmediatamente mostrará un color determinado, que puede ir desde el rojo al azul, dependiendo si es ácida o básica.
