Electrólisis
La conductividad eléctrica de las sustancias consiste en un desplazamiento de la carga eléctrica a través de ellas. Dicho movimiento de las cargas puede producirse de dos maneras distintas:
- A través de un flujo de electrones, como sucede en los metales, a los cuales se les conoce como conductores de primera especie.
- A través del movimiento de los iones positivos y negativos, mediante una disolución o mediante un compuesto iónico fluido. Esta forma de conductividad se conoce como conductividad iónica, también llamada, electrolítica, tratándose de la conductividad propia de los electrolitos que son conductores de segunda especie.
La electrólisis se puede definir como un proceso en el que el paso de la corriente eléctrica a través de una disolución o a través de un electrolito fundido, da como resultado una reacción de oxidación – reducción (redox), no espontánea.
La conductividad eléctrica se lleva a cabo en cubas o celdas electrolíticas, para poder reproducir una reacción de oxidación- reducción, en la electrólisis, proceso que tiene gran interés práctico.
Una cuba electrolítica es un recipiente en el cual se lleva a cabo el proceso de la electrólisis. Dicho recipiente contiene una disolución en la que se sumergen los electrodos, ambos conectados a una fuente de corriente continua, gracias a la cual la cuba recibe electrones.
Los electrodos son las superficies sobre las que tienen lugar las semirreacciones redox. Generalmente son de carácter inerte con respecto a los reactivos que se encuentran en la cuba electrolítica. En los electrodos podemos distinguir un cátodo, y un ánodo, al igual que ocurre en las pilas voltaicas.
- Ánodo: electrodo en el cual se produce la oxidación, éste va conectado al polo positivo de la fuente de corriente.
- Cátodo: electrodo donde se produce la reducción, éste se conecta al polo negativo de la fuente de corriente.
Las diferencias más destacables entre una pila y una cuba electrolítica son:
- En una pila voltaica, la reacción química produce energía eléctrica, en cambio en la cuba electrolítica es justo al contrario, la energía eléctrica produce una reacción química.
- En las pilas, hay dos electrolitos, y en las cubas electrolíticas solamente uno.
- Las reacciones redox son espontáneas en las pilas voltaicas, mientras que en las cubas electrolíticas, no lo es.
- En las pilas, el ánodo es el polo negativo, y el cátodo el positivo, viceversa en las cubas electrolíticas.
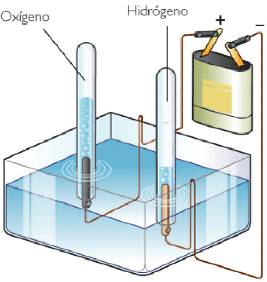
Un ejemplo de electrólisis puede ser el caso del agua. El agua pura no tiene la suficiente cantidad de iones libres como para que se pueda producir electricidad. Debido a esto, para lograr la electrolisis del agua, se suele añadir una cantidad pequeña de ácido sulfúrico (0.1 M). En estas disoluciones acuosas, se sumergen los electrodos inertes, que es donde ocurrirán las siguientes reacciones:
- Oxidación en el ánodo: 2 H2O (l) – 4 e^- → O2 (g) + 4H^+ (aq)
- Reducción en el cátodo: 4H^+ (aq) + 4e^- → 2 H2 (g)
- Reacción global: 2H2O (l) → 2H2 (g) + O2 (g)
Se ve claramente como se obtiene hidrógeno en el cátodo, y oxígeno en el ánodo, siendo el volumen del gas de hidrógeno, el doble del volumen de oxígeno.
Los aniones sulfato del ácido se oxidan después que el agua, éstos necesitan un potencial elevado para descargarse, así que no lo hacen. El ácido sulfúrico no es consumido.