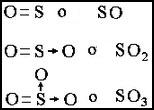Funciones Químicas Inorgánicas
Todas las sustancias y compuestos existentes en el reino Mineral pueden ser agrupados en cuatro grupos, conforme determinadas sustancias que presenten propiedades en común. Como ejemplo podemos usar las frutas separándolas en dos grupos:
A: Naranja, Ananá, Fresa, Limón, mandarinas
B: Guayaba, Caqui, Mango, Papaya
Para caracterizar mejor imaginemos el sabor de estas frutas frescas. La característica del grupo A es que son ácidas y las del grupo B son de sabor astringente.
Si fuesen mezcladas las frutas del grupo A el sabor será reforzado. Sin embargo si mezclamos el grupo A con el B, surgen nuevos sabores la acidez será atenuada o neutralizada.
El sabor agrio es una característica de las sustancias ácidas. Esto vale tanto para las frutas como para otros compuestos químicos. Debe existir alguna parte común entre las moléculas de algunas sustancias de estas frutas. Conceptuamos entonces función química como el conjunto de sustancias que poseen propiedades comunes. Estas propiedades se deben a grupos de átomos comunes
Existen cuatro funciones:
Óxidos, Bases, Ácidos y Sales.
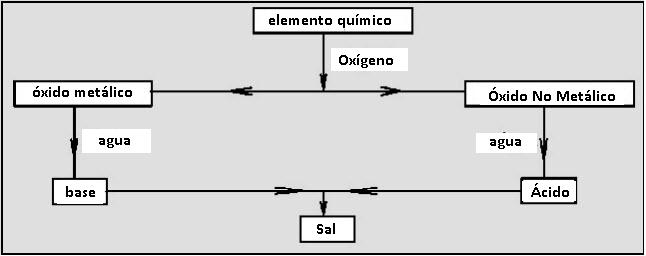
El esquema a continuación muestra la relación entre estos grupos:
Función Óxido
Los óxidos son compuestos cuya molécula está formada por el oxígeno y otro elemento químico cualquiera (compuesto binario). Este otro elemento puede ser un metal, un no metal o un semi-metal.
Óxidos Metálicos
Son los óxidos donde el elemento diferente del oxígeno es un metal. En este caso el compuesto es iónico. El anión O2 se llama óxido y el nombre compuesto será:
Oxido con nombre del Elemento + Valencia
Ejemplos:
Na1+ O2– quedará Na2O o bien, óxido de Sodio
Co2+ O2– quedará CoO o bien, óxido de cobalto II (debe ser mencionado pues también existe cobalto III)
Pb4+ O2– quedará PbO2 u óxido de Plomo IV (para no ser confundido con el Plomo II = Pb2+)
El óxido de aluminio deberá tener varios átomos de este material y del oxígeno en cantidad tales que la molécula, en su total, tenga cargas eléctricas positivas y negativas iguales (todos los átomos hacen todos sus enlaces).
Al2O3: Un truco práctico es que cuando las valencias fuesen diferentes, utilízalas como índices de los átomos.
Algunos metales poseen dos o más valencias diferentes. En este caso ofrecemos un sobrenombre en algoritmo romano al metal indicando su valencia:
FeO donde Fe2+ O2- óxido de hierro II
Fe2O3 donde Fe23+ O32- óxido de hierro III
PbO donde Pb2+ O2- óxido de plomo II
PbO2 donde Pb4+ O22- óxido de plomo IV
Óxidos No metálicos
Son aquellas que presentan elementos no metálicos ligados al oxígeno. Los elementos no metálicos no pierden electrones, por tanto no existen cargas eléctricas positivas (+) y negativas (-). La unión entre los átomos ocurre por entrelazamiento de electrones (pares electrónicos). Representamos a través de un guion medio (-) para cara par electrónico. Algunos elementos pueden “prestar” pares electrónicos al oxígeno, los cuales representamos a través de una pequeña flecha (=> )
Ejemplos:
Podemos aun suponer que existe una “valencia positiva” para los elementos no metálicos. Esta “valencia” la llamamos número de oxidación (NOx). De forma que podremos hacer las fórmulas químicas de los óxidos no metálicos con la misma facilidad que los metálicos. Estos NOx constan en la Tabla Periódica de los Elementos.
Ejemplos de NOx : S2+, S4+, S6+,N3+, N5+.
El nombre de estos óxidos será dado de la misma forma que los óxidos metálicos. O se puede aún indicar el número de elementos por los prefijos nomo (=1), di (=2), tri (=3), tetra (=4), etc.
S2+ O2- queda SO u óxido de azufre II o monóxido de azufre
S4+ O2- queda SO2 u óxido de azufre IV o monóxido de azufre
S6+ O2- queda SO3 u óxido de azufre VI o trióxido de azufre
N3+ O2- queda N2O3 u óxido de nitrógeno III, o trióxido de dinitrógeno.
N5+ O2- queda N2O5 u óxido de nitrógeno V, o pentóxido de dinitrógeno.