Principio de exclusión de Pauli
El principio de exclusión de Pauli, fue desarrollado por el físico austriaco Ernst Pauli en el año 1925. Este principio de la cuántica dice que dos partículas ( concretamente fermiones) que tiene los números cuánticos con los que constan idénticos, no pueden existir.
Esto significa que dos electrones ( fermiones) que se encuentren en un átomo no podrán poseer a la vez iguales números cuánticos. Este hecho explicaría que los electrones se dispersen en capas o niveles en torno al núcleo del átomo y por lo cual, los átomos que posean mayor número de electrones ocupen mayor espacio, debido a que aumenta el número de capas de las que consta el átomo. El número máximo de electrones que puede tener una capa o nivel es de 2n^2.
Para poder describir de forma completa al electrón dentro del átomo de hidrógeno, necesitamos introducir obligatoriamente un cuarto número cuántico a los ya conocidos. Dicho cuarto número cuántico se representa por las letras ms, y es conocido como el número cuántico de spin, el cual se encuentra relacionado estrechamente con las propiedades magnéticas que presentan los electrones. El número cuántico ms, tan sólo puede tener dos valores diferentes, +1/2 o -1/2. A los electrones cuyos valores de ms son iguales, se dice que cuentan con lo que se conoce como spines paralelos, sin embargo, si los valores que presenta ms son distintos se dice que poseen spines opuestos o también llamados antiparalelos.
Para poder describir a un orbital, se necesitan tres números cuánticos ( los números n, l y ml), a la vez que un electrón que se encuentra en un átomo viene dado por una combinación de cuatro números cuánticos, los tres principales más el número ms. El principio de exclusión de Pauli nos dice que en un átomo es imposible que coexistan dos electrones con los cuatro números cuánticos idénticos. Según establece este principio, en un orbital de tipo atómico, que se encuentra determinado por los números cuánticos n, l, y ml, solamente pueden haber dos electrones: uno de ellos con un spin positivo +1/2 y otro con su contrario spin negativo -1/2.
Este principio es fundamental en la estructura de la materia y tiene aplicaciones en diversas áreas de la física y la química. Por ejemplo, en la física de partículas, el principio de exclusión de Pauli es responsable de la estabilidad de la materia. Sin este principio, todos los electrones de un átomo podrían caer al estado de energía más bajo, lo que llevaría a una implosión catastrófica de la materia.
Además, el principio de exclusión de Pauli tiene implicaciones en la teoría de la superconductividad, un fenómeno en el que ciertos materiales pueden conducir electricidad sin resistencia. En este caso, los electrones forman pares, conocidos como pares de Cooper, que pueden moverse a través del material sin resistencia. Estos pares de electrones tienen spines opuestos, lo que es posible gracias al principio de exclusión de Pauli.
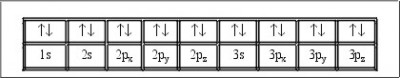
Entonces decimos que cada uno de los tipos de orbitales solamente puede contener 2 electrones como máximos, los cuales deberán obligatoriamente tener spines contrarios. Estos electrones tendrán todos sus números cuánticos iguales , y tan sólo se diferenciarán en el número cuántico ms ( spin).
Para entenderlo mejor, cuando distribuimos los electrones por capas, representamos un orbital con una flecha hacia arriba y otra hacia abajo, lo cual nos indicará que hay dos electrones en dicho orbital, pero que poseen spines diferentes. Este tipo de representación se conoce como configuración electrónica. Para realizar dicha representación de llenado de orbitales electrónicos, se comienza llenado el orbital S,, para seguidamente continuar con el siguiente orbital. Vamos insiriendo los electrones de uno en uno hasta completar enteramente el espacio del que cuenta el orbital
El principio de exclusión de Pauli también explica la estabilidad de la que constan los orbitales atómicos, así como la presión que realiza la materia degenerada. Este principio es fundamental para entender la estructura de la materia y tiene aplicaciones en diversas áreas de la física y la química.