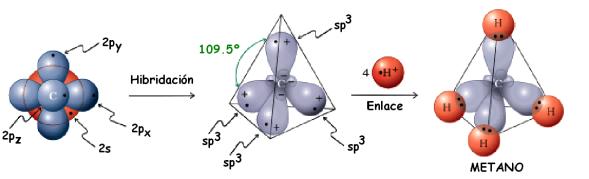
Hibridación del Carbono
Existen innumerables moléculas en que determinados elementos químicos establecen un cierto numero de enlaces covalentes comunes, más allá que estos enlaces no estuviesen previstos por la configuración electrónica de los átomos de esos elementos.
En el intento de explicar lo que sucede, se creó la teoría de la hibridación.
La palabra hibridación muchas veces se refiere al cruce de dos especies diferentes entre si, dando origen a una nueva especie, de características intermedias a aquellas de las especies de origen.
Es más o menos esa la idea que debemos tener en relación a la hibridación de orbitales.
Como el elemento carbono sufre varios tipos diferentes de hibridación y es un elemento químico muy importante, usaremos el carbono para ejemplificar la teoría de la hibridación.
Hibridación sp³ del carbono
Si observamos la configuración electrónica del átomo de carbono en estado fundamental, podemos concluir que el realiza apenas 2 enlaces covalentes comunes, porque posee apenas dos electrones desemparejados.
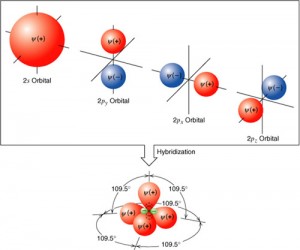
Experimentalmente esto no se verifica
El carbono, en las diversas moléculas que forma, realiza siempre 4 enlaces covalentes comunes. Es necesario admitir por tanto, que el carbono posee cuatro electrones desemparejados. La explicación acepta actualmente para este hecho la damos a continuación.
Un electrón orbital 2s del carbono es activado y promovido para el orbital 2pz, que estaba vacío, una vez que la diferencia de energía entre esos orbitales no es muy acentuada.
El carbono puede realizar 4 enlaces del tipo sigma. En este caso, todos son iguales y de igual energía y por tanto, los electrones deben estar ocupando orbitales iguales.
Esto no se verifica en el estado activado
Así, sucede una hibridación (mezcla, cruza) entre el orbital s y los 3 orbitales p de la capa de valencia del carbono, originando 4 orbitales nuevos e iguales denominados sp3
Como las cargas eléctricas del mismo signo se repelen, es lógico pensar que estos 4 electrones van a buscar orientar sus orbitales en una configuración espacial que les permita quedarse lo más distante posible unos de los otros.
La matemática prevé que la distancia máxima entre 4 ejes, se da en un ángulo de 109º28’.
Podemos visualizar, imaginando esos 4 ejes partiendo del centro de una pirámide tetraédrica y siguiendo en dirección a sus vértices.
De esto se concluye que la orientación de los 4 orbitales sp3 en el espacio sea exactamente esa, siempre considerando que el núcleo de carbono ocupe el centro de la pirámide tetraédrica imaginaria.
Resumiendo: el carbono que realiza cuatro enlaces sigma tiene:
- Hibridación sp3
- Geometría Tetraédrica
- Ángulo entre los orbitales híbridos de 109º28’
Otros elementos de la familia del carbono, el silicio y el germanio forman moléculas como SiH4, SiCl4, GeH4 e GeCl4, a través de ese mismo tipo de hibridación.