Modelos Generales Ácido – Base
Hoy en día existen diversas definiciones sobre ácidos y bases, entre las cuales se 3 se destacan. Ellas son debidas al químico sueco August Svante Arrhenius en 1884; al dinamarqués Johannes Nicolaus Bronsted y el inglés Thomas Martin Lowry en 1923 (trabajando independientemente uno del otro) y el tercero por el físico químico estadounidense Gilbert Newton Lewis ( 1875 – 1946) también en 1923, fecha de publicación de su libro “Valencia y Estructura de los Átomos y Moléculas” donde el expone su definición de ácidos y bases.
Definición de Arrhenius:
- Un ACIDO es una sustancia que, cuando adicionada al agua produce iones H3O+ (hidrón) o, más simplificado, H+ (protón, hidrógeno)
- Una BASE es una sustancia que, cuando adicionada al agua, produce iones OH– (hidroxilos)
Así como tenemos, ácido sulfúrico ( H2SO4 – presente en las baterías de los coches), ácido acético (CH3COOH – vinagre), ácido cítrico (HOOCCH2C(OH)COOHCH2COOH – Limón, Naranja…) ácido carbónico ( H2CO3 – coca-cola) son ácidos como muestran las siguientes reacciones
( eq. 1) = H2SO4(aq) ´´´´´´ > HSO4–(aq) + H+ (aq)
( eq. 2) = CH3COOH (aq) ´´´´´´ > CH3COO–(aq) + H+ (aq)
( eq. 3) = HO2CCH2COHCO2HCH2CO2H(aq) ´´´´´´ > HO2CCH2COHCO2HCH2COO–(aq) + H+ (aq)
(eq. 4) = H2CO3(aq) ´´´´´´ > HCO3–(aq) + H+ (aq)
Tenemos el hidróxido de sodio ( NaOH-soda cáustica), hidróxido de amonio (NH4OH ) e hidróxido de magnesio ( Mg(OH)2 – antiácidos) que son bases.
(eq. 5) = NaOH(aq) ´´´´´´ > Na+(aq) + OH–(aq)
(eq. 6) = NH4OH(aq) ´´´´´´ > NH4+(aq) + OH–(aq)
(eq. 7) = Mg(OH)2(aq) ´´´´´´ > Mg2+(aq) + 2OH–(aq)
Este modelo presenta entando, una desventaja. El restringe de manera drástica el número de reacciones que son consideradas como ácido-base.
A lo largo de los años fueron propuestos otros modelos, como el de Bronsted-Lowry, definiendo una reacción ácido-base como aquella en la cual hay una transferencia de protón de una especia para otra.
- ÁCIDO es la especie que libera o dona el ion H+, ya la
- BASE es aquella que acepta (o recibe) este ión.
Como ejemplo veamos las siguientes reacciones:
(eq. 8) = HCl(aq) ´´´´´´ > H+(aq) + Cl–(aq)
Aparentemente, no hay quien reciba el H+ donado por el HCl. Pero el receptor existe y es el agua en la cual el HCl se encuentra disuelto.
(eq. 9) = HCl(aq) + H2O ´´´´´´ > H3O+(aq) + Cl-(aq)
Aquí el agua actúa como una base según este modelo. Explicandolo mejor, por el modelo de Arrhenius, su ionización en agua. Ahora veamos la reacción:
(eq. 10) = HCO-3(aq) + H2O ´´´´´´ > H2CO3(aq) + OH-(aq)
Aquí el ión bicarbonato recibe el H+ proveniente del agua (y, el agua actúa como ácido). La siguiente reacción también es verdadera:
(eq. 11) = HCO-3(aq) + H2O ´´´´´´ > CO32-(aq) + H3O+(aq)
De acuerdo con las ecuaciones presentadas, el agua puede actuar tanto como una base como un ácido.
(eq. 12) = H2O + H2O ´´´´´´ > H3O+ + OH–
Ahora ya puede entenderse la ionización del agua cuando estudiamos Ph, ¿no?
En estas reacciones descriptas más arriba, se puede notar especies químicas que difieren apenas por un H+. Denominamos estas especies como par ácido-base conjugados.
La especie formada a partir de un ácido por la pérdida de un ión hidrógeno es llamada como base conjugada de aquel ácido. Ya, la formada a partir de una base por la ganancia de un ión hidrógeno es el ácido conjugado de aquella base, de esta forma:
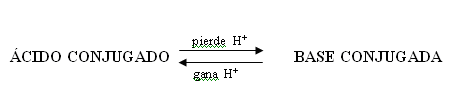
(eq. 13) = Ej: HCl(aq) + NH3(aq) ´´´´´´ > NH4+(aq) + Cl–(aq)

Se ve bien que el modelo de Bronsted-Lowry amplía el de Arrhenius, sin embargo, es restringido en importantes aspectos. Se aplica apenas a las reacciones que involucran transferencia de iones hidrógeno. Para que una especie sea definida como ácido en este modelo, debe contener, por lo menos, un átomo de hidrógeno ionizable.
Ya el tercer modelo, el de Lewis, remueve esta restricción:
- Ácido es la especie que acepta un par de electrones en una reacción dada.
- Base es la especie que dona este par de electrones.
Desde un punto de vista estructural, el concepto de base de Lewis, no difiere mucho del concepto anterior. Para que una especie reciba un ión hidrógeno ( base de B-L) ella debe poseer, por lo menos un par de electrones libres. Por ejemplo:
:PH3 / :NH3 / H2Ö: / :¨F:– pueden recibir un H+, formando
PH4+ / NH4+ / H3O+ / HF
Luego, el concepto de Lewis no cambia de modo significativo el número de especies que se comportan como bases. En tanto, el concepto de ácido aumenta considerablemente el número de especies con esta característica. Substancias que acepten un par de electrones pueden ser un ión hidrógeno, un metal cargado positivamente, una molécula con octeto incompleto…
(eq. 14) = H+ + H2O: ´´´´´´ > H3O+
(eq. 15) = Zn2+ + 4:NH3(aq) ´´´´´´ > Zn(NH3)42+
(eq. 16) = BF3 + :NH3 ´´´´´´ > F3B-NH3

Características Ácido-Base de Sales
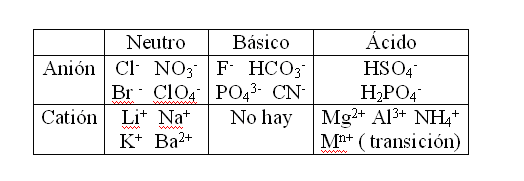
Las propiedades ácido-base de una sal dependen del comportamiento de sus iones. Algunos iones no ejercen efecto sobre la concentración de H+ en la solución. Se denomina tales iones como neutros. Sin embargo, otros iones son capaces de variar la concentración de H+ para mas o para menos que 10-7 M (valor para el cual la solución es neutra a 25 ºC).
Los iones neutros son aquellos derivados de ácidos y bases fuertes, tales como Cl– , NO3– , ClO4– , Li+, Na+, K+. Un ácido (o base) fuerte, se ioniza según la reacción:
HA ´´´´´´ > H+ + A–
BOH ´´´´´´ > B+ + OH–
La tendencia del sentido inverso de estas reacciones es muy pero muy baja. O sea, ellos, cuando están en solución, no tienden a combinarse con H+ o OH–.
Los aniones básicos son aquellos provenientes de ácidos débiles (porque no hay cationes básicos?). Un ácido débil tiene la siguiente ecuación:
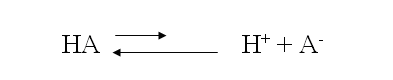
El equilibrio de esta reacción esta desplazado hacia la izquierda. Enseguida, un anión A– adicionado a una solución tenderá a combinarse con iones H+, tornando el medio con mayor cantidad de O H– (básico). Iones ácidos son todos los cationes, con excepciones de los alcalinos y algunos alcalino térreos y los aniones de poliácidos )1ª ionización).
En resumen