Las pilas
 Las reacciones de oxidación-reducción, tienen una aplicación práctica importante en las diferentes pilas que utilizamos hoy en día. Las pilas nos dan energía eléctrica de manera sencilla, pudiendo aplicarla a diferentes aparatos de uso diario.
Las reacciones de oxidación-reducción, tienen una aplicación práctica importante en las diferentes pilas que utilizamos hoy en día. Las pilas nos dan energía eléctrica de manera sencilla, pudiendo aplicarla a diferentes aparatos de uso diario.
Gastón Planté, en 1856, fabricó la primera pila usable y recargable, a base de plomo y ácido. Siendo George Leclanché, en el año 1866, quien patentó la pila de zinc-carbono, también conocida como célula Leclanché. Pero quizás el más famoso, y al que se le suele atribuir el invento de la pila, es a Alessandro Volta, que inventó la pila voltaica en 1800.
Existen diferentes tipos de pilas:
Pilas secas:
Actualmente se utilizan en muchos aparatos de uso cotidiano, como las radios, linternas, despertadores, etc. En estas pilas, el ánodo tiene una recubierta de cinc y su cátodo es una barra de grafito. El electrolito se encuentra compuesto por una pasta húmeda, mezcla de NH4Cl, ZnCl2, MnO2 con relleno inerte.
Las pilas secas generalmente generan un voltaje de 1,5 V.
Cuando se trata de pilas secas alcalinas, éstas llevan además un electrólito básico de KOH, que les produce una más larga duración.
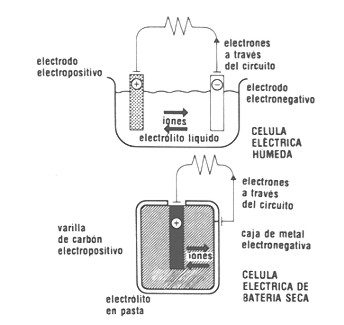
Pilas de mercurio:
Se utilizan sobre todo en relojes de pulsera y aparatos médicos, como pueden ser los marcapasos o audífonos. En éste caso, el ánodo es de cinc amalgamado con mercurio y su cátodo es de acero.
Poseen un electrolito muy alcalino, formado por ZnO, y HgO. Éste tipo de pilas, poseen una duración mucho mayor que las pilas secas, produciendo un constante voltaje.
Pilas voltaicas:
Las pilas voltaicas o también conocidas como electroquímicas, son dispositivos que permiten la producción de una corriente eléctrica partiendo de una reacción de oxidación-reducción de carácter espontáneo.
Pilas de níquel- cadmio:
Se trata de pilas de tipo recargable, gracias a la aplicación de una fuente externa con corriente continua. Se suelen usar en relojes eléctricos, cámaras fotográficas, calculadoras, etc., teniendo mayor vida que las pilas secas.
Su ánodo es de cadmio, y el cátodo de NiO2, con un electrolito básico.
Pilas litio:
Las pilas de litio en estado sólido, usan como electrolito un sólido polimérico, que produce el paso de los iones entre los electrodos. El ánodo de las pilas es de litio, de ahí su nombre, y el cátodo de TiC2 o también de V6O13.
Este tipo de pilas puede llegar a tener un voltaje de 3V, y también son recargables.
Pilas de combustión:
Estas pilas basan su funcionamiento en la reacción de combustión con un combustible electroquímico, es decir, que produce energía eléctrica, y no calorífica. En cada electrodo ocurre por separado la reducción y la oxidación.
En la pila de combustión, hidrógeno-oxígeno, el electrolito está formado por una disolución de KOH. Por medio del comportamiento del ánodo y del cátodo, se burbujea continuamente hidrógeno e oxígeno. El funcionamiento de este tipo de pilas puede compararse con el de un motor de combustión interna, aunque su rendimiento es bastante mayor.
Las pilas de combustión se utilizan con buenos resultados en las naves espaciales, sirviendo de complemento energético.
Baterias de plomo:
Las baterías de plomo se usan normalmente en los automóviles para dar energía eléctrica al motor. Están formadas por seis pilas de 2 V cada una que se encuentran conectadas en serie. Cada pila costa de dos rejillas de plamo, siendo una de ellas el ánodo, rellena de plomo esponjoso y la otra el cátodo, rellena de PbO2.
El electrólito de estas pilas es de H2SO4, en disolución acuosa del 40%.
Los acumuladores de plomo, son de tipo recargable, mediante una fuente externa por electrolisis aplicada.

