Propiedades de los éteres
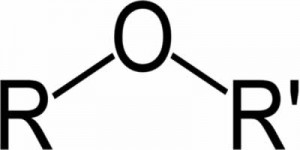
Un éter, es un compuesto químico cuyo grupo funcional se caracteriza por tener dos cadenas de carbono unidas a través de un átomo de oxígeno (R-O-R’, en donde las R son grupos alquilo unidos al oxígeno).
Propiedades físicas y estructurales:
Los éteres estructuralmente pueden ser considerados derivados del agua o de los alcoholes, en los cuales se ha cambiado uno o más hidrógenos por cadenas carbonatadas.
La estructura angular que poseen los éteres se puede entender si tenemos en cuenta una hibridación sp^3 para el oxígeno, el cual posee dos pares no compartidos de electrones. No puede formar enlaces de hidrógeno con sí mismo, siendo sus puntos de ebullición y fusión bastante más bajos que los de los alcoholes que se encuentren relacionados.
El oxígeno, electronegativo, otorga a los éteres un ligero momento dipolar y sus puntos de ebullición por lo general, aunque similares, son más altos que los de los alcanos correspondientes.
El ángulo que existe entre el enlace carbono-hidrógeno-carbono, no es el típico de 180º, por lo cual los momentos dipolares que presentan cada uno de los enlaces C-O no se ven anulados, lo que lleva en consecuencia a que los éteres tengan un momento dipolar al que podemos llamar neto.
En cuanto a los éteres de tipo cíclico, éstos se comportan como si fueran acíclicos pues las propiedades químicas del grupo funcional que nos ocupa son exactamente las mismas, sin importar si se trata de una cadena abierta o de un anillo. Los éteres cíclicos más comunes, como pueden ser el tetrahidrofurano o el dioxano, se utilizan con asiduidad como disolventes, ya que éstos son inertes, aunque es cierto que pueden llegar a romperse cuando son tratados con ácidos muy fuertes.
En los éteres cíclicos, los únicos que se comportan de una forma diferente son los compuestos cíclicos que se encuentran formados por tres miembros, es decir, los llamados epóxidos. A ellos, la tensión que posee el anillo les da una reactividad química un tanto especial, y es quizás éste hecho el que los haga tan útiles en cuanto a síntesis química se refiere.
Los éteres son ligeramente solubles en agua y carecen de coloración. Poseen aromas agradables como ocurre con los ésteres. El éter más pequeño se encuentra en condiciones normales en estado gaseoso, y los más pesados en cambio, en estado sólido.
Propiedades químicas:
Los éteres por lo general tienen muy poca reactividad química, esto es debido a lo difícil que es romper el enlace carbono- oxígeno (C-O). Es por ello, que vienen utilizados muy frecuentemente como disolventes de tipo inerte en reacciones de la química orgánica.
Los éteres no poseen hidrógenos activos como pueden presentar otros compuestos (alcoholes o ácidos). Debido a ello, los éteres son inertes frente a compuestos metálicos como pueden ser los elementos del primer grupo de la tabla periódica u otros como el litio. Se ven necesitados de calor para poder descomponerse, pudiendo sólo así reaccionar con algunos metales.
Los éteres cuando se encuentran expuestos al aire, experimentan una oxidación lenta, la cal da lugar a peróxidos bastante inestables y muy poco volátiles. Dichos peróxidos son un peligro cuando procedemos a destilar un éter, pues suelen concentrarse en el residuo de la destilación, pudiendo generar una explosión. Para evitar dicho indeseable efecto, los éteres deben ser conservados con un hilo de sodio, o simplemente añadiéndoles, antes de comenzar la destilación, un poco de sustancia reductora, como puede ser por ejemplo, el LiAlH4.