Orbital atómico
La hipótesis de De Broglie, se pudo comprobar en 1927, al observarse el comportamiento ondulatorio de los electrones en fenómenos de difracción. Los electrones que giran alrededor del núcleo se pueden considerar ligados a éste, pudiendo describirse el movimiento ondulatorio que realizan los electrones mediante ecuaciones de onda. Siguiendo esta idea, Schrödinger estudió matemáticamente el comportamiento del electrón en el átomo, obteniendo la famosa ecuación de Schrödinger.
Un orbital atómico, se puede decir que es una zona del espacio donde hay una gran probabilidad, casi mayor del 90%, de encontrar al electrón, lo que supone poder considerar al electrón o electrones, como una nube indefinida cargada que gira entorno al núcleo, donde hay mayor densidad en las zonas donde la probabilidad de encontrar al electrón, es mayor.
El significado físico de la ecuación de Schrödinger viene dado por la asignación de unas restricciones conocidas como números cuánticos, simbolizadas de igual manera que en el modelo atómico de Bohr:
n: número cuántico principal
l: número cuántico del momento angular
m: número cuántico magnético
s: número cuántico del spin electrónico
Cada número atómico toma un valor permitido:
El número atómico “n”: puede tomar valore de números enteros, 1, 2, 3…
Para “l”: toma valores de números enteros que van desde 0 hasta (n-1)
Para “m”: se permiten todos los valores entre +1 y -1 ( incluyendo el cero)
Para “s”: sólo se permiten los números fraccionarios entre -1/2 y +1/2.
Los valores del número cuántico “n”, representan el tamaño del orbital, o l o que es lo mismo, su cercanía al núcleo. En cambio, los valores del número cuántico “l”, representan el tipo del orbital:
Cuando l= 0, el orbital es de tipo s
Si l=1, los orbitales serán de tipo p
Si l= 2, los orbitales serán de tipo d
Si l=3, los orbitales son de tipo f.
Siendo las letras “s”, “p”, “d” y “f”, las que identifican los tipos de orbitales, tratándose de las iniciales de los nombres que tienen los diversos grupos de líneas espectrales que se relacionan con cada orbital, que son:
Sharp: líneas bien marcadas, nítidas pero de poco intensidad.
Principal: líneas intensas
Difuse: líneas difusas
Fundamental: líneas frecuentes en muchos y distintos espectros.
También existen otros tipos de orbitales, como d, h, etc., pero los elementos conocidos, en sus estados normales no cumplen condiciones cuánticas para que se den estos tipos de orbitales.
Los valore de “m”, se refieren a la orientación que posee el orbital, en cambio “s”, hace referencia al momento angular de giro que posee un electrón en el átomo.
Los cuatro números cuánticos en conjunto, tratan de definir a un electrón, pero no pueden existir en el mismo átomo, dos electrones con todos los números cuánticos iguales. Debido a esto, una vez definido el tamaño, tipo y orientación de un orbital, usando los tres primeros números cuánticos, o lo que es lo mismo, los valores n, l y m, sólo se puede encontrar como máximos dos electrones en la nombrada situación, teniendo necesariamente valores diferentes, al menos en cuanto al valor de espín se refiere.
En cuanto a la forma de los orbitales, se usan las formas de la parte angular dando por hecho los nodos radiales que siempre tendrán forma esférica:
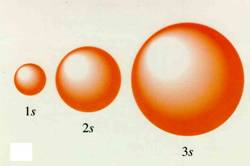
Orbital s:
El orbital s, tiene forma esférica alrededor del núcleo del átomo. Hay varias formas de representarlos, como por ejemplo, a modo de nube electrónica, donde la probabilidad de encontrar a un electrón se representa con mayor densias de puntos. O también representando el volumen circular donde probablemente el electrón pasa mayor cantidad de tiempo.
Orbital p:
Los orbitales p, tienen una geometría de dos esferas unidas por un punto, y achatadas por la unión de ambas. Estas esferas se encuentran orientadas según los ejes de coordenadas. Este orbital expresa también la energía que tiene un electrón.

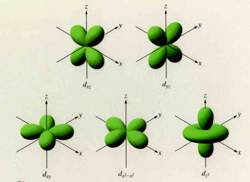
Orbital d:
Los orbitales d, tienen diferentes formas. Tienen formas lobulares con signos alternados o un doble lóbulo con un anillo que los rodea.
Orbital f:
Estos orbitales tienen formas bastante diversas, que vienen de añadir un plano nodal a las formas de los orbitales d.

