Ley de Boyle-Mariotte
Los gases representan el estado físico de la materia, en el cual los valores de volumen, densidad y forma propia no son definidos.
Presentan alto grado de desorden causado por el dislocamiento libre de partículas que lo constituyen.
Las propiedades de los gases son variables, de hecho el existir diferentes espacios entre los elementos que lo componen, puede variar su volumen, densidad o presión.
Estudio de los gases.
Por poseer gran movilidad, los gases tienden a dispersarse ocupando rápidamente todo el espacio del recipiente en el cual están contenidos.
El estudio académico de los gases consigue dividirlos en dos grupos bien definidos, los gases reales y los gases ideales.
Estos últimos son aquellos que presentan una proporción directa entre su volumen, temperatura y presión de forma predecible.
De entre todas las propiedades de los gases se podrían representar las más usuales.
Presión: Sumatoria de fuerzas que cada componente de un gas ejerce sobre el recipiente que lo contiene.
Volumen: Espacio ocupado por un gas en un determinado recipiente.
Temperatura: Estado térmico de agitación de las moléculas de un gas.
Y esas variables sobre los gases ideales son representadas mediante las siguientes formulas.
Ley de Boyle-Mariotte -> PV = K
Ley de Charles -> VT-¹ = K
Ley de Gay-Lussac -> PT-¹ = K
Estas leyes en los gases ideales muestran la constante en las variables P (Presión), V (Volumen) y T (Temperatura).
Frente a los gases reales es donde tales leyes no se aplican.
Obs.: T-1 = 1/T
Ley de Boyle-Mariotte
Considere cierta cantidad de gas a una temperatura constante dentro de un sistema cerrado.
Recordemos que un sistema cerrado es aquel que permite el intercambio de calor con el medio exterior, pero no permite el pasaje de materia.
Cuando se ejerce una presión determinada sobre el gas, su volumen disminuye de forma directamente proporcional a la presión ejercida sobre el mismo.
Este proceso sucede lentamente, de modo que el tiempo gastado en cada variación infinitesimal sea suficiente para que el sistema entre en un equilibrio térmico con el medio exterior.
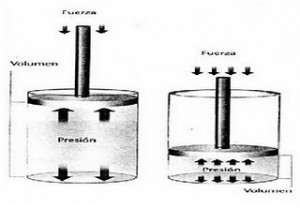
Básicamente la ley de Boyle-Mariotte constituye la descripción de un sistema que sufre una transformación isotérmica.
O sea que estamos hablando de un proceso donde la temperatura se mantiene constante.
De esta forma el producto resultante de P y V es una constante.
P1.V1 = P2.V2 o P.V = k
Siendo K una constante.
El valor exacto de la constante K no es necesario saberlo para poder hacer uso de la ley.
Boyle efectuó un experimento similar al ejemplo antes mencionado, donde coloco un gas en un cilindro con un émbolo, y denoto que al bajar el émbolo la presión sobre el gas aumentaba proporcionalmente a la disminución de su volumen.
Su utilización mas practica es el en el mundo del buceo donde mediante la aplicación de la ley se puede determinar la duración de una botella de aire comprimido y su rendimiento a determinada profundidad.
Si bien el estudio de las propiedades de los gases puede resultar insignificante para muchas personas, es de considerar que debemos mucho de nuestro desarrollo tecnológico a la capacidad de manipular dichos elementos, desde la conquista de nuestros océanos a la aventura espacial.

