La Electroquímica
La electroquímica alcanza todo proceso químico que envuelve la transferencia de electrones. Cuando un proceso químico ocurre, produciendo transferencia de electrones, es llamado de pila o batería, pero cuando el proceso químico es provocado por una corriente eléctrica (variación de cantidad de electrones), este proceso es denominado electrólisis.
Resumiendo, la pila y batería son procesos químicos que ocurren espontáneamente y generan corriente eléctrica, ya la electrólisis es un proceso químico (reacción química) que ocurre de forma no espontánea, o sea, ocurre en la presencia de una corriente eléctrica.
La primera pila fue creada en 1800 por Alessandro Volta, que utilizaba discos de cobre y zinc, separados por algodón embebido en una solución salina.
Los discos fueron llamados de electrodos, siendo que los electrones salían del zinc rumbo al cobre, haciendo una pequeña corriente fluir.
En 1836, John Frederick Daniell, construyó una pila con electrodos de cobre y zinc, pero cada electrodo era colocado en una celda individual, lo que aumentaba la eficiencia de la pila, porque ella poseía un tubo que ligaba las dos cubas, este tubo fue llamado puente salino. Esta pila se hizo conocida como pila de Daniell.
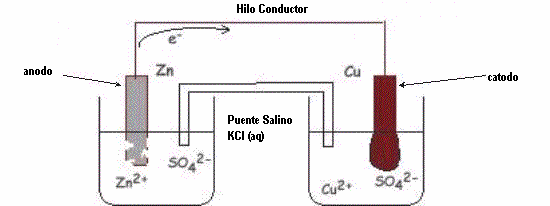
Cátodo es el electrodo positivo, es el electrodo donde ocurre la reducción, ocurre ganancia de electrones, ya el ánodo, es el electrodo negativo, es el electrodo donde ocurre oxidación, ocurre pérdida de electrones.
En esta pila es posible verificar las semi-ecuaciones de la reacción:
Cu2+ +2e– –> Cu(s)
el ión cobre (Cu2+) de la solución es reducido por 2 e– que vienen de la corriente eléctrica
Zn(s) –> Zn2+ + 2e–
el zinc es oxidado, formando ión zinc (Zn2+) y 2 e–. Estos electrones serán responsables por la generación de corriente eléctrica del sistema (pila).
Cu2+ + 2e– –> Cu0
Zn0 –> Zn2+ + 2e–
_________________________________
Zn0 + Cu2+ –> Zn2+ + Cu0
Con el desarrollo de la reacción, ocurrirá formación de cobre metálico, que se depositará en la superficie del electrodo de cobre, ya el electrodo de cobre será corroído, pues el zinc se esta transformando en iones que irán para la solución de sulfato de zinc.
La pila de Daniell puede ser escrita por:
Zn0 + Cu2+(aq) –> Zn2+(aq) + Cu0
o
Zn | Zn2+ || Cu2+ | Cu
donde, || representa el puente salino.
Puente Salino
Tiene la función de evitar que las soluciones de ambas cubas se mezclen, siendo también su función, talvez la principal, la de evitar que exista un exceso de cargas en las cubas.
En el caso de la pila de Daniell, la cuba electroquímica que contiene el electrodo de zinc y la solución de sulfato de zinc, queda con exceso de cargas positivas, siendo entonces activado por el puente salino, para disminuir esta concentración haciendo con que la pila no pare de funcionar. Lo mismo sucede en la cuba que contiene el electrodo de cobre, pero con la carga opuesta.
Toda pila posee un potencial, o sea, produce un voltaje, siendo que este potencial medido en la pila, en el caso de las pilas comerciales, que se usan en radios, controles remotos, y juguetes, el voltaje generalmente es de 1,5V, solo variando el tamaño de reserva de las pilas, pudiendo ser A, AA, D, etc.
El potencial de la pila puede ser dado, de una manera simplificada por:
![]() E = Emayor – Emenor,
E = Emayor – Emenor,
siendo Emayor y Emenor, los potenciales padrones de reducción de cada semi ecuación.
El potencial padrón es medido en relación al hidrógeno, que tiene por convención, la denominación de potencial padrón de Hidrógeno, que vale 0 V.
Es a partir del potencial de una pila, que se sabe si la reacción ocurre o no. Cuando la variación del potencial de la pila, ![]() E, es mayor que cero, la reacción es espontánea. Cuando el potencial es negativo, la reacción no ocurre espontáneamente y cuanto mayor fuese el potencial positivo, mayor será la eficacia de la pila.
E, es mayor que cero, la reacción es espontánea. Cuando el potencial es negativo, la reacción no ocurre espontáneamente y cuanto mayor fuese el potencial positivo, mayor será la eficacia de la pila.
A partir de esto es posible verificar algunos hechos que ocurren en nuestro día a día y que son explicados por las reacciones electroquímicas.

