Enlace Covalente Simple
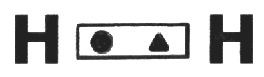
Es el tipo de enlace que ocurre cuando los dos átomos precisan adicionar electrones en sus últimas capas. Solamente compartiendo es que se puede asegurar que estos átomos alcancen la cantidad de electrones necesarios en sus últimas capas. Cada uno de los átomos involucrados entra con un electrón para la formación de un par compartido, que a partir de la formación pasará a pertenecer a ambos de los átomos. Ocurre entre No metales y No metales; No metales e Hidrógeno; y entre Hidrógeno e Hidrógeno.
El Hidrógeno posee solamente una capa conteniendo un único electrón, compartiendo 1 electrón, alcanza la cantidad necesaria para la capa K, que es de dos electrones. Los electrones compartidos pasan a ser contados para las electrosferas de los dos átomos participantes en el enlace.
Además de los ejemplos mencionados, hay otras moléculas que también forman enlaces covalentes simples. Por ejemplo, la molécula de agua (H2O) se forma a través de dos enlaces covalentes simples entre dos átomos de hidrógeno y un átomo de oxígeno. En este caso, cada átomo de hidrógeno comparte un electrón con el átomo de oxígeno, permitiendo que todos los átomos alcancen una configuración electrónica estable.
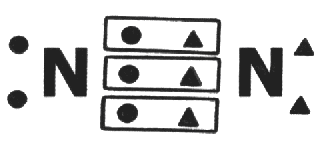
En la molécula de Nitrógeno ocurren tres enlaces covalentes entre los dos átomos.
7N 2 – 5
Estos tres enlaces garantizan que los dos átomos de nitrógeno alcancen la cantidad de ocho electrones en sus últimas capas. El enlace covalente entre dos átomos iguales es llamada apolar, pues en ella, los electrones son compartidos de manera igual, ninguno de los átomos tiene más fuerza que el otro para atraer electrones para si.
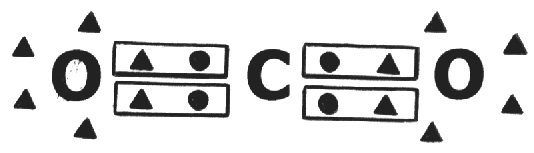
La molécula de CO2 es formada por dos átomos de oxígeno y uno de carbono unidos a través de enlaces covalentes
6C 2 – 4 8O 2 – 6
El átomo de carbono comparte 4 electrones y cada átomo de carbono 2, garantizando así que ambos alcancen los ocho electrones en las últimas capas.
Como el enlace es entre átomos diferentes y con diferente electronegatividad, el enlace es llamado de polar, porque el átomo de oxígeno atrae para si, más fuertemente los electrones compartidos.
Además de la fórmula electrónica, los compuestos covalentes pueden ser representados por la fórmula estructural, donde cada par compartido es representado por un trazo. Por ejemplo
H – H, O = C = O.
Un enlace covalente uniendo dos átomos es llamado simple. El conjunto de dos enlaces uniendo dos átomos es dicho de enlace doble. El conjunto de tres enlaces uniendo dos átomos es llamado entonces de triple enlace.
Es importante destacar que los enlaces covalentes simples son fundamentales para la formación de moléculas biológicas esenciales para la vida, como las proteínas, los ácidos nucleicos y los lípidos. Estos enlaces permiten la formación de estructuras tridimensionales complejas y estables, que son esenciales para las funciones biológicas de estas moléculas.