Compuesto iónico
Compuesto iónico es aquel que se forma cuando un átomo de baja afinidad electrónica cede electrones, convirtiéndose en anión, mientras otro átomo gana esos electrones, dada su alta afinidad por los mismos, convirtiéndose en catión. Un ejemplo muy común de este tipo de compuesto es la sal de mesa, cloruro de sodio.
El sodio tiene un único electrón en su capa más externa, y lo pierde con facilidad, mientras que el cloro tiene siete electrones en su capa externa, y gran facilidad para ganar un electrón y completar dicha capa. Entonces, al suceder la transferencia de electrones, el cloro pasa a tener carga negativa (Cl–) y el sodio, carga positiva (Na+ ). Al tener cargas de signo contrario, la fuerza electrostática hace que los iones cloro y sodio se atraigan, formando un sólido cristalino.
Estas fuerzas de atracción, originadas por los iones, actúan uniformemente en el espacio, sin dirección preferente, es por eso que cada ion positivo tratará de rodearse por todos lados por iones negativos, y viceversa, formándose de esta manera la estructura cristalina.
Dado que la fuerza electrostática actúa sobre el conjunto de átomos, no se puede observar una molécula aislada de cloruro de sodio, ni de ningún compuesto iónico, sino que las moléculas se disponen en una red sólida cristalina. En el caso de la sal común, esta red es cúbica, y se dispone de tal manera que cada átomo de cloro queda rodeado de seis átomos de sodio, como se puede observar en la figura que sigue.
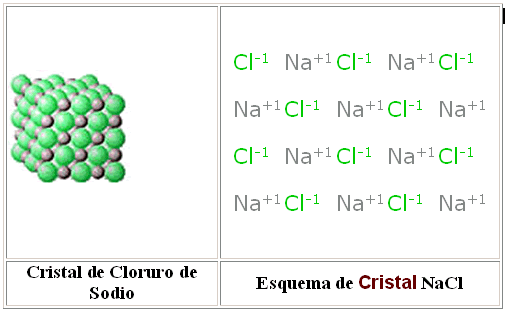
Generalmente, un elemento del Grupo I A ( Li, Na, K, Rb, Cs, Fr ) puede formar cristales iónicos con un elemento halógeno o del Grupo VII A ( F, Cl, Br, I ) ; es común que un metal y un no metal se enlacen de esta manera.
Características de los compuestos iónicos:
- Son sólidos cristalinos, de estructura muy ordenada, en forma de red.
- Punto de fusión elevado, por lo general más de 400 º C. Esto es consecuencia de la fuerza de atracción que une los iones cuando se encuentran formando la red cristalina.
- Las uniones por fuerza electrostática se rompen con facilidad al agregar un solvente polar, agua por ejemplo, disolviendo el compuesto, obteniéndose los aniones y cationes por separado.
Los compuestos iónicos, en estado líquido o disuelto, conducen la electricidad, gracias a la movilidad de sus iones. En cambio, en estado sólido, el compuesto no es conductor, debido a la gran fuerza de atracción que existe entre los iones cuando se encuentran en forma de cristal, que no les permite moverse y conducir la corriente eléctrica.
Además de la sal de mesa, existen otros ejemplos de compuestos iónicos que son comunes en nuestra vida diaria. El bicarbonato de sodio (NaHCO3), por ejemplo, es un compuesto iónico que se utiliza en la cocina para hacer que los alimentos suban. El carbonato de calcio (CaCO3), otro compuesto iónico, es la principal componente de las conchas de los moluscos y de las perlas.
Los compuestos iónicos también tienen aplicaciones industriales. Por ejemplo, el cloruro de magnesio (MgCl2) se utiliza en la fabricación de papel, textiles y cerámica. El nitrato de potasio (KNO3), otro compuesto iónico, se utiliza en la fabricación de fertilizantes y explosivos.
Es importante señalar que los compuestos iónicos son diferentes de los compuestos covalentes, en los que los electrones se comparten entre los átomos, en lugar de ser transferidos de un átomo a otro. Los compuestos covalentes suelen ser líquidos o gases a temperatura ambiente, a diferencia de los compuestos iónicos, que son sólidos.
En el ámbito de la salud, los compuestos iónicos también juegan un papel importante. Por ejemplo, muchos medicamentos son compuestos iónicos que interactúan con el cuerpo humano a nivel molecular. Los iones de sodio y potasio, por ejemplo, son esenciales para el funcionamiento normal de las células nerviosas y musculares.
En resumen, los compuestos iónicos son una parte esencial de la química y tienen una amplia gama de aplicaciones en la vida diaria y en la industria.

