Historia de la Tabla Periódica
La Tabla Periódica de Elementos Químicos
La tabla periódica de elementos químicos, es conocida como un fuente certera y veraz a la hora de verificar la información, cuando se desea saber las características de los elementos que la componen como verificar cuales son metales, cuales son los mas densos, los mas pesados o reactivos.
Pero la tabla periódica que hoy conocemos no fue siempre así, disponer los elementos obedeciendo a sus semejanzas fue un tema de gran discusión y estudio científico.
Sin embargo la tabla que conocemos hoy en día esta basada en tablas anteriores de características primitivas y limitadas.
Clasificación de Dobereiner – Ley de las Triadas (1857)
Johann W. Döbereiner (1780-1849), científico Alemán. Observo que muchos elementos podían ser agrupados de tres en tres, de acuerdo a ciertas semejanzas con las mazas atómicas.
Proximidad
Fe = 56u
Co = 59u
Ni = 58u
Como podemos observar el Hierro, Cobalto y Níquel poseen mazas atómicas similares lo que refleja una proximidad innegable entre los tres elementos
Diferencia Común
Li = 7u
Na = 23u
K = 39u
Obsérvese la diferencia entre las masas de los tres elementos consecutivos, responden a un patrón común creciente equivalente a 16 de echo 23 – 7 = 16; 39 – 23= 16.
Media aritmética.
Ca = 40u
Sr = 88u
Ba = 137u
Efectuando la media aritmética entre las masas de Calcio y Bario podemos obtener la masa atómica aproximada del Estroncio: 137+40 = 177; 177/2 = 88,5
Clasificación Chancourtois – Anillo Telúrico
Alexander Béguyer de Chancourtois (1820-1886), químico ingles, organizo los elementos de la siguiente forma; inicialmente, dividió la superficie de un cilindro en 16 columnas he hileras horizontales correspondientes a las masas atómicas.
Chancourtois atribuyo al oxigeno una masa atómica equivalente a 16u; posteriormente trazo una línea helicoidal que comenzaba en el oxigeno como punto 0, y terminaba en el décimo sexto elemento de mayor masa atómica, hasta donde la línea alcanzaba.
Repitió dicho procedimiento hasta que todos los elementos fuesen colocados sobre las líneas divisorias del cilindro.
La tabla periódica que pudo organizar nuestro químico tomo una forma similar a la figura que lo representa.
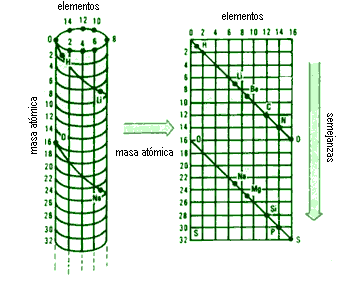
Considerándose elementos semejantes aquellos que se encuentran sobre la misma vertical, como Carbono y Silicio o Nitrógeno y Fósforo
Clasificación de Newlands – Ley de las Octavas (1864)
John A. R. Newlands (1838-1898, profesor de química industrial ingles, idealizo la clasificación de los elementos por el orden creciente de sus masa atómicas, los conformo en grupos de 7 dispuesto de lado a lado sobre una cuadricula.
Conformada su cuadricula Newlands percibió que las propiedades químicas eran semejantes entre el primero y octavo elemento al contar de izquierda a derecha como las notas musicales de se repiten en cada octava
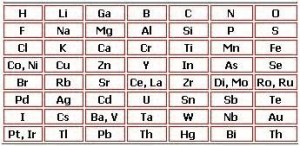
Es así que los elementos que siguen la misma línea vertical poseen las mismas características químicas, como es el caso del Litio, Sodio y Potasio, Magnesio y Calcio.
El fracaso de las clasificaciones antiguas y el modelo actual.
A pesar de ser prometedoras, los modelos antiguos de clasificación de elementos presentaban muchas incompatibilidades
Ley de las Triadas
Este método fue considerado ineficaz por ser muy limitado y solamente atender algunos elementos.
Anillo Telúrico
La aceptación de este método fue pequeña, ya que los valores estimados de las masas atómicas de los elementos eran erróneos e imprecisos.
Ley de las Octavas
Este modelo también fue derrumbado debido a su ineficacia referente al cálculo de las masas atómicas de los elementos.
O sea algunos elementos se encontraban en lugares que no correspondían, es el caso del Cloro y el Flúor que por ejemplo no poseen características semejantes al Cobalto ni al Níquel.
A pesar de los diversos fracasos y diferentes métodos y teorías echadas por tierra, todas ellas contribuirían a la creación de la tabla periódica que hoy conocemos y concebimos como tal.
Dos científicos que trabajaban de forma totalmente paralela, lograron resultados increíblemente similares, ellos son Julius Lothar Meyer (1830-1895) e Dmitri Ivanovitch Mendeleev (1834-1907), siendo el trabajo de este ultimo el más osado.
Mendeleev presento su modelo de clasificación de elementos frente a la real Sociedad Rusa de Química, donde obtuvo gran aceptación.
El científico afirmaba que las propiedades de los elementos son una función periódica de sus masas atómicas.
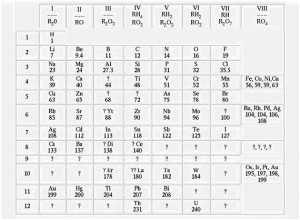
La tabla periódica actual no es una copia fiel de la tabla de Mendeleev, la que poseemos en nuestros días se encuentra mas perfeccionada, no necesariamente debido a la aparición de nuevos elementos que se incorporaron a ella, sino en mayor medida por un concepto generado en el año 1913 hablamos del numero atómico.
Henry G. L. Moseley definió que la verdadera identidad de un elemento no esta relacionada directamente con la masa del mismo, sino con la carga nuclear del átomo que lo representa.
Así logro modificar levemente la tabla propuesta por Mendeleev la permanece hasta nuestros días.

