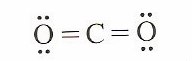Moléculas con pares de electrones no compartidos
En la mayoría de moléculas que utilizamos a diario en la química, los pares de electrones de la capa de valencia del átomo central se encuentran compartidos por otros átomos. Sin embargo, hay muchas otras moléculas e iones de tipo poliatómicos en los cuales el átomo central tiene algún que otro par de electrones que no se encuentran compartidos. Dichos pares, también conocidos como pares no enlazantes, poseen importantes repercusiones en lo que a la geometría de la molécula se refiere.
Además de las moléculas de amoníaco y agua, existen otros ejemplos interesantes de moléculas con pares de electrones no compartidos. Un ejemplo notable es el dióxido de azufre (SO2). En esta molécula, el átomo de azufre tiene seis electrones de valencia, de los cuales cuatro se comparten con los átomos de oxígeno y dos no se comparten. La geometría resultante es una forma angular, similar a la del agua.
Otro ejemplo es el ácido sulfúrico (H2SO4), una molécula más compleja con un átomo de azufre en el centro. El azufre comparte dos de sus seis electrones de valencia con los átomos de oxígeno y los otros cuatro electrones no se comparten. La geometría resultante es una forma tetraédrica, similar a la del amoníaco.
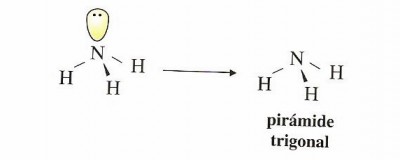
Así por ejemplo, en la molécula de amoníaco (NH3), el nitrógeno posee cuatro pares de electrones en su capa de valencia, de los cuales tres se encuentran compartidos con los átomos de hidrógeno, y uno de los pares no está compartido. La distribución de la geometría hace mínimas las repulsiones entre los cuatro pares de electrones, siendo una geometría de tipo tetraédrica. De los cuatro vértices con los que cuenta el tetraedro, tres se encuentran ocupados por átomos de hidrógeno, y el cuarto vértice por un par de electrones no enlazante, o no compartido, como vemos en la siguiente figura:
La geometría que resulta de dicha distribución es una pirámide de tipo trigonal, que posee una base que se encuentra formada por tres átomos de hidrógeno.
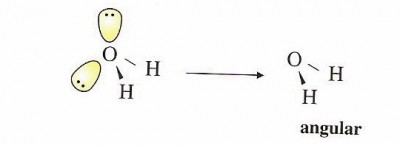
La estructura de Lewis para la molécula de agua (H2O), nos indica que el oxígeno posee cuatro pares de electrones en su capa de valencia, de los cuales dos son compartidos con los átomos del hidrógeno, y otros dos no se encuentran compartidos. Igual que sucedía en el caso anterior, la distribución de geometría que presentan los cuatro pares de electrones es de tipo tetraédrica. Dos de los vértices que posee el tetraedro se encuentra llenos por los átomos de hidrógeno y los otros dos, se encuentran ocupados por pares de electrones que no están compartidos, lo que nos da en consecuencia, una geometría molecular angular, como se ve en la siguiente figura:
Así, tanto en el caso del amoníaco, como el en caso de la molécula de agua, los ángulos de enlace que presentan se encuentran analizados de manera experimental, son algo más pequeños que el ángulo que presenta un tetraedro ( 109,5º).
La razón de esto, es la naturaleza distinta que presentan los pares de electrones que se encuentran en la capa de valencia: los pares de electrones no enlazantes o no compartidos cuentan con una necesidad espacial bastante mayor que los pares de electrones que se encuentran compartidos. Los electrones no compartidos se encuentran atraídos solamente por el núcleo central del átomo, mientras que los electrones que si están compartidos se encuentran bajo la atracción de dos núcleos distintos pertenecientes a dos átomos.
Consecuentemente, los ángulos de enlace que se presentan, tienden a cerrarse de manera ligera, y dicho efecto es bastante más visible en la molécula de agua que en la de amoníaco, pues en el H2O el átomo central posee dos pares de electrones no enlazantes, mientras que en el amoníaco solamente posee uno. El ángulo de enlace entre H-N-H es de 107,5º, y es mayor que el ángulo de enlace existente entre H-O-H, que es de un valor de 104,5º.
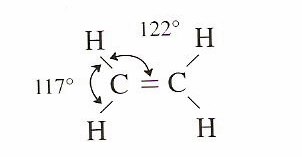
En el caso de las moléculas con enlaces múltiples, su geometría también puede ser entendida si aplicamos el modelo de repulsión entre los diferentes pares de electrones presentes en la capa de valencia. Así por ejemplo, la estructura que tiene la molécula de eteno ( C2H4) sería :
Vemos claramente que entre los dos átomos de carbono existe un enlace de tipo doble. A pesar de que cada uno de los átomos de carbono cumple bien la regla del octeto, para poder conocer la geometría de la molécula solamente necesitamos tener en cuenta las tres posiciones, pues los dos pares de electrones compartidos entre los carbonos se encuentran ocupando la misma posición, la zona internuclear. Por lo cual, la geometría que presentan cada uno de los átomos de carbono es la conocida como triangular plana. Pero, la mayor necesidad de espacio de los pares de electrones en la misma posición cambia la geometría, y por tanto los ángulos de enlace que se encuentran son algo diversos de los ángulos teóricos de 120º.
De igual modo, la estructura de Lewis para la molécula de CO2, es de geometría lineal:
El átomo de carbono cuenta con cuatro pares de electrones en su capa de valencia, pero en cuanto a la geometría se refiere, ocupan tan sólo dos posiciones y la manera de minimizar las repulsiones es haciendo que la molécula sea geométricamente lineal.
Es importante destacar que la presencia de pares de electrones no compartidos también puede afectar las propiedades físicas y químicas de las moléculas. Por ejemplo, las moléculas con pares de electrones no compartidos a menudo tienen puntos de ebullición más altos que las moléculas similares sin pares de electrones no compartidos. Esto se debe a que los pares de electrones no compartidos pueden participar en interacciones de tipo dipolo-dipolo, que son más fuertes que las fuerzas de dispersión de London que predominan en las moléculas sin pares de electrones no compartidos. Además, los pares de electrones no compartidos pueden participar en reacciones químicas, actuando como bases de Lewis y aceptando protones para formar enlaces covalentes.