Mezcla química
Las mezclas como sabemos son constituidas por más de una sustancia. El aire atmosférico, el agua del mar y hasta el agua mineral son mezclas. En nuestro día a día lidiamos mucho más con mezclas que con sustancias puras, inclusive que no sepamos que algunas lo son.
Para entender mejor esta cuestión, es importante conocer el concepto de fase, bastante simple e intuitivo. Cuando observamos una muestra y conseguimos detectar una porción uniforma, con características iguales en toda su extensión, detectamos una fase.
Pensemos en un vaso conteniendo agua de mar. Más allá que sepamos que se trata de una mezcla, no percibimos cualquier diferencia en la muestra o sea ella posee apenas una fase.
Pensemos ahora en un vaso que contiene agua y aceite. Sabemos que no se mezclan y fácilmente identificamos una porción con agua y una con aceite. Ese sistema (muestra) posee dos fases.
Importante: Las fases no están ligadas al estado físico. Nosotros podemos como en el ejemplo del agua y el aceite tener dos fases líquidas dentro del mismo sistema.
Mezclas Homogéneas
Son aquellas cuyos componentes no son fáciles de distinguir. Ellas son perfectamente uniformes y por tanto monofásicas. Ejemplos: 1) aire atmosférico 2) Agua del Mar.
Mezclas Heterogéneas
Son aquellas formadas por más de una fase. En ellas logramos distinguir más de un componente. Ejemplos 1) Agua y Aceite – 2) Aire y Polvo+
Identificando muestras homogéneas y Heterogéneas
Mezclas heterogéneas son fácilmente identificables ya que en la mayoría de las ocasiones visualmente reconocemos más de una fase. Pero en las que son homogéneas? Como podemos saber si una muestra es pura o una mezcla?
La respuesta a ello es la curva de calentamiento
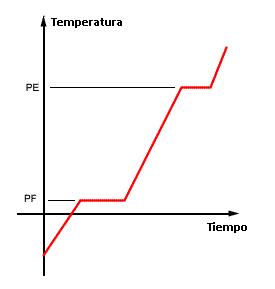
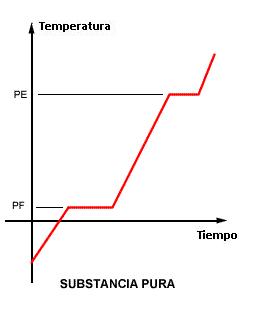
La curva de calentamiento es el gráfico que muestra la variación de temperatura de una muestra cuando es calentada o enfriada incluyéndose los cambios de estado físico.
Sabemos que durante un cambio de estado físico la temperatura permanece constante (Q=mL) y que durante el calentamiento sin cambio de estado, su variación es lineal (Q=mcΔT). Entonces la curva de arriba es clásica, mostrando dos niveles, uno en el punto de fusión (PF) y otro en el punto de ebullición (PE).
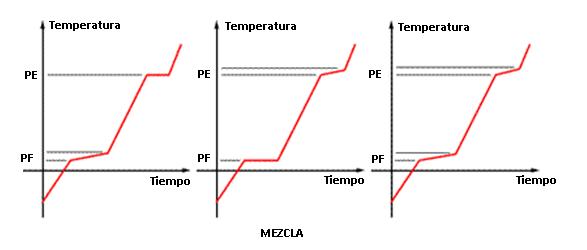
Levantando experimentalmente la curva de calentamiento de una muestra, son cuatro las cosas que pueden suceder:
- La curva presenta temperatura constante en el punto de fusión y ebullición
- La curva presenta variación de temperatura en el punto de fusión y en el de ebullición permanece constante
- La curva presenta temperatura constante en el punto de fusión y variación de temperatura en el de ebullición.´
- Cuando los dos puntos (PF y PE) son constantes – caso 1 – La muestra corresponde a una sustancia pura. En cualquier otro caso (2,3 o 4), se trata de una mezcla.
Mezcla Química Común, Eutéctica y Azeotrópica
Cuando la curva presenta variación en dos puntos (PF y PE) decimos que es una mezcla común. Cuando es solamente en uno de los puntos que se presenta la variación, esa mezcla recibe los nombres de:
- Azeotrópica: PF varía y PE permanece constante
- Eutéctica: PF permanece constante y PE varía.
Ejemplos comunes de estas mezclas son el agua y alcohol (para muestras azeotrópicas) y hielo y sal de cocina (para mezclas eutécticas).
En resumen:
- Mezcla: formada por más de una sustancia
- Fase: Porción homogénea de una mezcla
- Interface: superficie de separación de fases
- Mezcla común (o simple): PF y PE varían
- Mezcla azeotrópica: PE constante
- Mezcla eutéctica: PF constante