Electrodos Polarizados y no Polarizados
De acuerdo con los usos comunes en electroquímica, el término electrodo se utiliza indistintamente para denominar el material que compone el conductor electrónico (por ejemplo: electrodo de plata) o ese material mas el componente principal de la solución electrolítica (por ejemplo: electrodo de Ag/Ag+, indicando un electrodo de plata inmerso en una solución que contiene iones plata).
Cuando se inyecta una carga eléctrica en un electrodo a través de una fuente externa pueden suceder dos situaciones extremas:
a – La carga se acumula en la interfase electrodo/solución. En este caso, la diferencia de potencial a través de la interfase depende de la carga inyectada lo que ilustra la forma de controlar externamente esa diferencia.
En este caso, el electrodo se dice polarizado. Un ejemplo de esta situación sería la inyección de cargas moderadas en un electrodo de plata inmerso en una solución que no contiene iones Ag+ u otros capaces de transferir carga para el electrodo de plata.
b – La carga inyectada se filtra a través de la interfase siendo transferida a algunas de las especies en solución. Asumiendo que esta transferencia sea infinitamente rápida, será observado que la diferencia de potencial a través de la interfase permanece inalterada. En este caso, el electrodo se denomina no polarizado. Un ejemplo de esta situación sería un electrodo de plata en equilibrio con una solución que contiene iones Ag+. Los sistemas comprobadamente estables y que mantienen el potencial inalterado a través de la filtración rápida de cargas inyectadas son las más indicadas para ser utilizadas como electrodos de referencia.
Electrodos idealmente polarizados
a – La doble capa siempre se forma cuando las dos fases son colocadas en contacto
b – Para un electrodo inmerso en una solución, existe una región interfasial con espesura de algunos angstroms, donde ocurren los fenómenos electroquímicos cuyas propiedades son ansiotrópicas.
c – Existe una diferencia de potencial eléctrico entre el electrodo y el interior de la solución.
d – Esta diferencia de potencial resulta de la adsorción de iones y de dipolos, también pudiendo haber un componente que hubiera sido impuesto externamente.
Para muchos sistemas electrolíticos, la diferencia de potencial interfacial (Δφ) es del orden de 0,5 V, en cuanto que la espesura de la doble capa (xo) es del orden de 10 Å, indicando que el campo eléctrico en la región ( Δφ / xo ) es del orden de 5×106 V/cm2. Este valor considerablemente elevado resalta la importancia del estudio de la doble capa, pues es bajo la influencia del campo eléctrico que ocurren las reacciones electroquímicas.
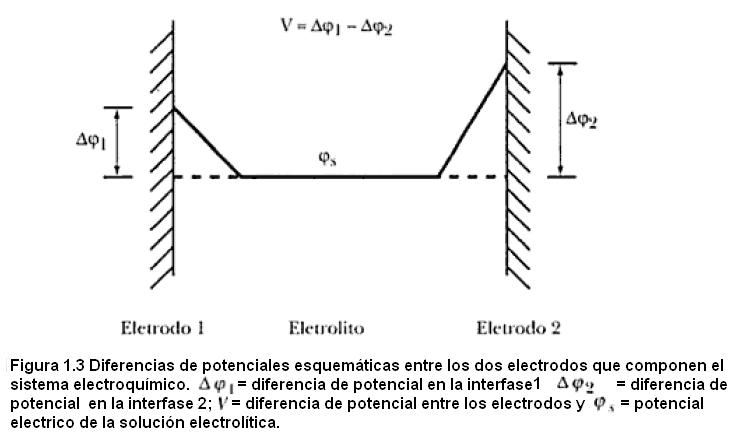
A pesar de muy importantes, se verifica que los valores de Δφ no pueden ser medidos experimentalmente por causa de la imposibilidad termodinámica de medirse diferencias de potencial entre fases con diferentes composiciones químicas y también porque los sistemas electroquímicos deben ser compuestos necesariamente por, como mínimo, dos electrodos. Así, considerando que las terminales del aparato de medida son de la misma composición, la diferencia de potencial medida es la variación entre las diferencias de potenciales de dos interfases (Figura 1.3).
En verdad, este es un problema que afecta no solamente los estudios de la doble capa, sino también los estudios de termodinámica electroquímica y de la cinética electroquímica. En termodinámica, por ejemplo, para contornear el problema de la medida de potenciales electrolíticos individuales, se eligió un electrodo de referencia – el electrodo estándar de hidrogeno – que sería el segundo del sistema electroquímico para el cual, convencionalmente, se atribuyó el valor de Δφ = 0. En los estudios de doble capa, normalmente se adopta el siguiente procedimiento.
a – Se aplica una perturbación eléctrica en la interfase del electrodo en estudio.
b – Se selecciona el segundo electrodo de forma que los fenómenos que ocurren en su interfase no estén afectados por esta perturbación (electrodo de referencia, no polarizable).
c – Se miden las variaciones que ocurren en Δφ como función de esta perturbación eléctrica.
Siendo así, como V = Δφ1 – Δφ2 y Δφ2 es independiente de la perturbación (P), (dV / dP) = (dΔφ1 / dP), o sea que las variaciones de la diferencia de potencial entre los electrodos en función de la perturbación son efecto apenas de las variaciones que ocurren en la interfase en estudio. Un ejemplo concreto de aplicación de estos conceptos es la obtención experimental de curvas electrocapilares.
Los conceptos y ecuaciones termodinámicos que se aplican a la doble capa eléctrica son válidos para interfases en equilibrio donde no estén ocurriendo reacciones electroquímicas, o sea, en electrodos polarizados.
Así, la mayoría de los estudios son efectuados teniendo como perturbación eléctrica aplicada la interfase en estudio a las variaciones impuestas externamente a diferencia de potencial de equilibrio de esta interfase.
Por ejemplo, utilizándose un potenciostato se puede aumentar o disminuir la diferencia de potencial a través de la interfase, o sea, hacer con que Δφ sea mayor o menor. Entre tanto, un cuidado importante debe ser tomado para que los valores de Δφ, negativos o positivos no estén muy elevados, de forma que no induzca la ocurrencia de una reacción electrólítica.
En el intervalo de diferencias de potencial en que esto ocurre, se dice que el electrodo está idealmente polarizado o que la interfase electrodo/solución es idealmente polarizable y en estas circunstancias los fenómenos apenas relacionados con el ordenamiento de iones y/o dipolos, alterando la estructura y la composición de la doble capa para cada valor de Δφ, aplicado.
Un ejemplo común es el electrodo de mercurio inmerso en una solución de HCl 0,1 M. En el intervalo de potenciales entre -0,7V y 0,2V, medido en relación al electrodo reversible de hidrógeno, ninguna reacción electroquímica ocurre. Por debajo de -0,7V sucede la reacción de reducción del H+:
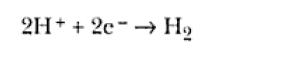
en cuanto que por encima de 0,2V ocurre la reacción de oxidación del mercurio del electrodo:
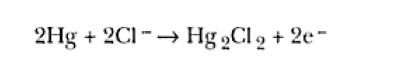
Por otra parte exiten sistemas experimentales que es prácticamente imposible establecer un intervalo de potenciales en el cual el electrodo se comporte como idealmente polarizado. Un ejemplo de ello sería un electrodo de platino inmerso en una solución 0,1M de HCl. En este caso, las regiones de potencial donde suceden la adsorción de hidrógeno (H+ y e– ==> Ho) y la oxidación de la platina (Pt + HO– – e– ==> PtOH) prácticamente se superponen.
En una situación extrema, se puede considerar al electrodo de mercurio con la superficie recubierta por un film de calomelano (Hg2Cl2, sal insoluble), inmerso en una solución de HCl. Para este electrodo, en la medida en que se intenta mudar externamente Δφ alterando su valor de equilibrio natural, la interfase reacciona provocando una reacción electroquímica anódica o catódica (filtración de cargas), dependiendo del signo de la perturbación. El resultado es que el valor de Δφ permanece prácticamente inalterado. Este tipo de electrodo es no polarizable como ya fue discutido.
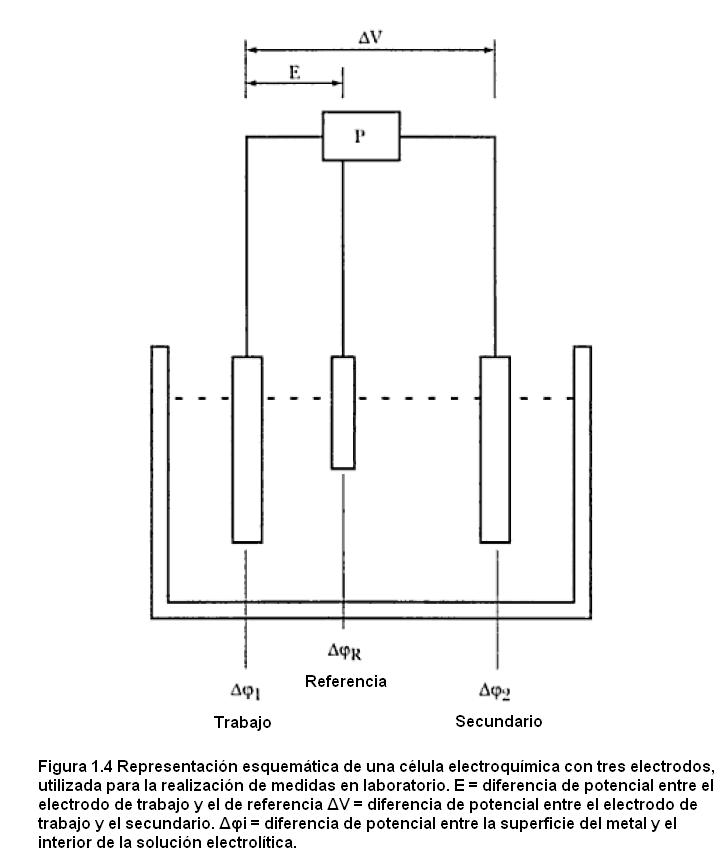
En laboratorio es bastante común que se utilicen células con tres electrodos para la realización de las medidas experimentales conforme está ilustrado en el esquema de la figura 1.4. El potenciostato es un equipo electrónico de respuesta muy rápida que controla la diferencia de potencial entre el electrodo de trabajo y el de referencia. Esta puede ser mantenida fija o variar de forma predeterminada a través de una perturbación introducida en el potenciostato. Como ya fue discutido, variaciones de esta diferencia de potencial se traducen en variaciones en Δφ1 o sea en función de E (curvas electrocapilares).