Sitio activo
El sitio activo de una enzima, también llamado centro activo, es la zona de la enzima a al cual se une el sustrato, para que la reacción se produzca.
Las enzimas son proteínas. Ciertas características en su estructura terciaria son las que determinan la forma del sitio activo de la enzima, y por lo tanto delimitan los sustratos sobre los cuales la enzima podrá actuar. Dicho de otra manera, la estructura tridimensional de la enzima determina también la estructura del sitio activo, y le brinda especificidad a la enzima, que sólo podrá actuar sobre ciertos sustratos: aquellos capaces de unirse a su sitio activo.
Muchas veces, el sitio activo tiene la forma de una hendidura o una cavidad en la estructura de la enzima. El sitio activo suele estar formado por cadenas laterales de residuos específicos, y es por esta razón que con frecuencia tiene una estructura tridimensional distinta al resto de la enzima. La estructura y composición del centro activo está configurado para que únicamente un determinado sustrato tenga la afinidad suficiente como para unirse a esta zona de la enzima.
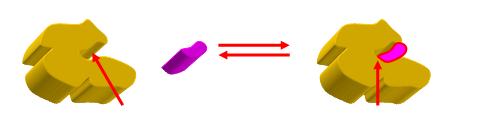
En la figura de arriba, la flecha roja de la izquierda señala el sitio activo de una enzima, representada en color amarillo. A la derecha, la flecha señala el sitio activo ocupado con sustrato.
La mayoría de las enzimas son proteínas globulares, con tamaños muy variables, que pueden ir desde 62 hasta 2500 aminoácidos. En la mayoría de los casos, las enzimas tienen un tamaño mucho mayor que el sustrato sobre el cual actúan. Sólo una pequeña parte de la enzima constituye su sitio activo, tan sólo tres o cuatro aminoácidos actúan directamente en la catálisis.
Las enzimas también pueden tener sitios para unión de cofactores, muchas veces necesarios para la reacción catalítica, o para unión de otras moléculas pequeñas, por ejemplo sustrato o productos de la reacción catalizada. La unión de la enzima con sus sustratos o productos puede aumentar o disminuir la velocidad de la reacción, de modo que la acción de la enzima puede ser regulada por retroalimentación (también llamado feedback) positivo o negativo.
El sitio activo de una enzima puede ser degradado por acción del calor, pHs extremos o por acción de algunas sustancias químicas, porque estos factores causan desnaturalización de las proteínas, es decir, degradación de sus estructuras terciarias, con la consecuente deformación del sitio activo enzimático.
Dada la alta especificidad observada en la mayoría de las enzimas, respecto del sustrato sobre el cual actúan, y respecto de la reacción que catalizan, Emil Fischer sugirió en 1894, que habría una complementariedad geométrica entre una enzima y su sustrato, de manera que podrían ser representados como una llave y una cerradura, que encajan perfectamente. Si bien este modelo explica la especificidad de la acción enzimática, no puede explicar el estado de transición que logran las enzimas.
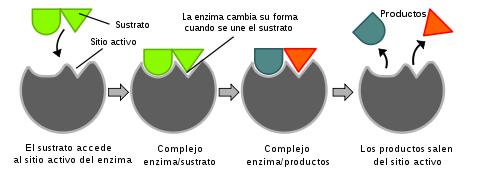
En el año1958, Koshland sugiere que el sitio activo de la enzima puede cambiar ligeramente su conformación, al unirse el sustrato. De esta manera, la enzima puede realizar su acción catalítica, luego de la cual se libera el producto, y el sitio activo vuelve a su conformación original. Este es el proceso representado en la figura que sigue: