Que es el Soluto
Aproximadamente 90% de las reacciones químicas se dan con los reactivos disueltos en algún líquido. Muchas de las cosas que consumimos también son soluciones. De allí la importancia de que entendamos algunas cosas sobre soluciones.
Una solución es siempre compuesta de dos cosas: una que disuelve, que llamaremos de solvente, y otra que es disuelta, que llamaremos de soluto. Así, cuando llevamos un susto y nuestra abuela prepara un vaso con agua y azúcar para que nos calmemos, ella prepara una solución donde el agua es el solvente y el azúcar es el soluto. Lo que quizás ella no sepa es que agua con azúcar no tiene ningún efecto calmante…
Nuestro «calmante de la abuela» puede estar muy o poco dulce. Químicamente hablando, lo que está variando es la concentración. Cuanto más dulce esté, más azúcar se halla disuelto y más concentrada es la solución.
Concentración
La concentración es la relación entre la cantidad de soluto y el volumen de la solución. Es bastante obvio que si colocamos una cuchara de té de azúcar en un vaso con agua el resultado será menos dulce que si colocamos una cuchara de sopa de azúcar en el mismo vaso con agua. La primera solución es menos concentrada que la segunda, o sea, posee menos masa de soluto que la segunda, para el mismo volumen de solvente.
Matemáticamente podemos escribir una expresión para calcular la concentración:
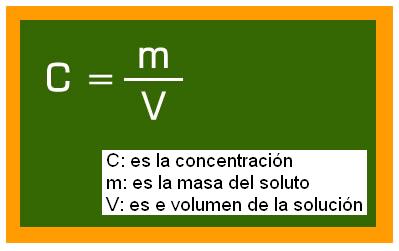
Todos sabemos que la cantidad de soluto que puede ser añadida a un solvente no es infinita. Si nuestra abuela, al preparar nuestro vaso con agua y azúcar, exagera en la cantidad de azúcar, parte de él no será disuelto, permaneciendo sólido en el fundo del vaso. A continuación se puede concluir que existe un límite para la cantidad de soluto. Es lo que llamamos de coeficiente de solubilidad.
Todo puede parecer medio confuso, pero lea con atención y entenderá esos conceptos perfectamente:
Concentración máxima
Tenemos un cierto volumen de solvente puro, o sea, no le añadimos nada – todavía. Comenzamos a poner, bien despacio, pequeñas cantidades de soluto. En la medida que se va haciendo, la concentración comienza a aumentar. Continuamos añadiendo soluto, la concentración continúa aumentando hasta que colocamos una pizca del soluto y este no se disuelve más. Llegamos a la máxima concentración que esa solución puede tener y, aunque le agreguemos más soluto, la concentración no se alterará más.
Entienda que la concentración es la relación de la masa del soluto disuelto en un cierto volumen de solución. Si colocamos soluto en exceso y él no se disuelve, él no será parte de la solución, quedará depositado en el fondo del recipiente en estado sólido y por lo tanto no ejercerá influencia a la concentración.
Vea que ello nos remite a algo muy interesante: si nos gusta el café bien dulce, existe un límite de cantidad de azúcar que podemos ponerle al café para que se disuelva. Toda lo que le agreguemos de más quedará depositado en el fondo de la taza y no hará que el café quede más dulce, sólo desperdiciaremos más azúcar.
Concentración y densidad
Algún lector debe haber visto en la imagen del pizarrón y se cuestionó: ¿La relación de la masa y el volumen no es la densidad?
Si lo es, pero fíjese en el siguiente detalle: aunque podamos escribir las dos expresiones como m/V, en concentración «m» representa la masa sólo del soluto, mientras que en la densidad la «m» representa la masa total de la solución (soluto + solvente). Vea también que cuando la concentración aumenta (añadido de soluto), la densidad también aumenta, pues estamos añadiendo más masa a la solución.

