Propiedades del Nitrógeno
Historia: El nitrógeno fue descubierto en 1722, por Priestley.
El nitrógeno gaseoso constituye cerca del 78% del aire atmosférico de la tierra y forma varias sales solubles presentes en el suelo, que son utilizados por las plantas.
Propiedades Físicos-Químicas:
El nitrógeno exige una gran variedad de estados de oxidación, que puede ser verificado por los siguientes ejemplos: -3 en el amoníaco (NH3), -2 en la hidracina (N2H4), -1 en la hidroxilamina (NH2OH), 0 en el nitrógeno molecular (N2), +1 en el óxido nitroso (N2O), +2 en el óxido nítrico (NO), +3 en el ácido nitroso (HNO2), +4 en el dióxido de nitrógeno (NO2) e +5 en el ácido nítrico (HNO3).
Pasando una chispa eléctrica a través del N2 gaseoso a bajas presiones, se puede obtener el nitrógeno activo. Esa forma de nitrógeno atómico reacciona con diversos elementos, rompiendo muchas moléculas normalmente estables.
El compuesto de nitrógeno de mayor importancia es el amoníaco, cuyo punto de ebullición es mayor de lo que se debería esperar, debido a la formación de puentes de hidrógeno en estado líquido. El carácter fuertemente básico del amoníaco hace de el un excelente donador de electrones. Así, el forma sales de amoníaco [NH4]+ y también compuestos de coordinación con iones metálicos, como por ejemplo el [Co(NH3)6]3+.
La hidracina (N2H4) es un líquido humeante cuando es expuesto al aire, de olor semejante al del amoníaco. Algunos de sus derivados son utilizados como combustibles para cohetes y buses espaciales.
La hidracina es obtenida por las siguientes reacciones:
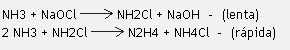
El nitrógeno puro es obtenido industrialmente por la destilación fraccionada del aire enfriado. El nitrógeno líquido (-180o C) es muy utilizado en la conservación de embriones, semen y otros materiales, además de encontrar usos en la medicina como antiséptico para la remoción de verrugas en la piel. Los nitratos son empleados como fertilizantes agrícolas y en la fabricación de explosivos y el nitrito utilizado en test de laboratorio.
Junto con el ácido clorhídrico, el ácido nítrico (en la proporción de 3:1) forma aguarás único solvente capaz de disolver el oro y otros metales nobles, más resistentes a los ácidos.

