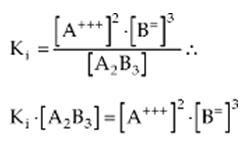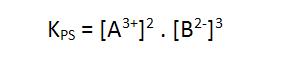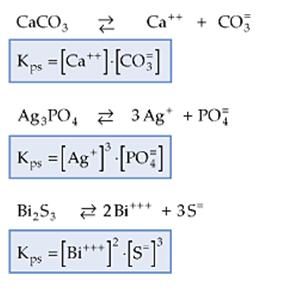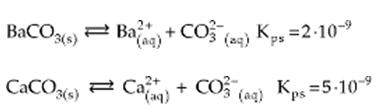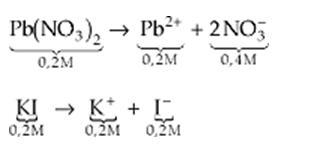Producto de Solubilidad (PS o KPS)
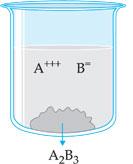
Existen substancias poco solubles en agua como, por ejemplo, BaSO4. Añadiendo cierta cantidad de sulfato de bario al agua, vemos que gran parte va hacia el fondo, formando un precipitado constituido de BaSO4 que no se disuelve.
Sin embargo, sabemos que la disolución de la sal no terminó. En realidad, la sal continúa disolviéndose, y precipitándose, estableciendo un equilibrio dinámico. Este equilibrio se llama heterogéneo o polifásico porque es el equilibrio que se establece en Um sistema heterogéneo.
Constante del Producto de Solubilidad (PS o KPS o KS)
Supongamos una solución de electrolito A2B3, poco soluble, en presencia de su cuerpo al piso (parte insoluble). La parte que se disolvió está bajo la forma de iones A+++ e B=, mientras la parte no-soluble está bajo la forma no-ionizada A2B3. Existe, así, un equilibrio dinámico entre A2B3 y sus iones en la solución, que puede ser representada por la ecuación:
Como todo equilibrio, este también debe obedecer la ley:
Como la concentración de un sólido tiene valor constante, el producto Ki · [A2B3] de la fórmula de arriba también es constante y se llama producto de solubilidad.
Por lo tanto, el producto de solubilidad (Kps o PS) es el producto de las concentraciones molares de los iones existentes en una solución saturada, donde cada concentración es elevada a un exponente igual al respectivo coeficiente del ion en la correspondiente ecuación de disociación.
Ejemplos:
La expresión Kps es utilizada solamente para soluciones saturadas de electrolitos considerados insolubles, porque la concentración de iones en solución es pequeña, resultando soluciones diluidas.
Kps es una grandeza que sólo depende de la temperatura. Cuanto más soluble el electrolito, mayor la concentración de iones en solución, mayor el valor de Kps; cuanto menos soluble el electrolito, menor la concentración de iones en solución, menor el valor de Kps, desde que las substancias comparadas presente la misma proporción entre los iones.
Ejemplo
Como presentan la misma proporción en iones (1 : 1), CaCO3 es más soluble que BaCO3, porque posee mayor valor de Kps.
Cuando las substancias comparadas poseen proporción en iones diferentes, la más soluble es aquella que presenta mayor solubilidad.
Ejemplo
Kps = [Ag+]2 · [CrO42-]
4·10 –12 = (2x)2 · x
4·10 –12 = 4x3
X = 1,0.10-4 mol/L
solubilidad del Ag2CrO4, por lo tanto, en 1 L de solución es posible disolver hasta 10–4 moles de Ag2CrO4.
BaSO4(s) <=> Ba2+(aq) + SO42-(aq) KPS=1,0 . 10-10
Y mol/L Y mol/L Y mol/L
KPS=[Ba2+].[SO42-]
10-10=(Y).(Y)
Y=1,0.10-5 mol/L
solubilidad de BaSO4 por lo tanto, en 1 L de solución es posible disolver hasta 10–5 mol de BaSO4.
Con eso concluimos que Ag2CrO4 es más soluble que BaSO4.
Efecto del Ion Común
La adición de ion común al equilibrio provoca un desplazamiento en el equilibrio hacia la izquierda, disminuyendo la solubilidad del electrolito.
Consideremos inicialmente una solución saturada de electrolito AB, sin la presencia del cuerpo de fondo:
AB(s) <=> A+(aq) + B–(aq)
La adición de iones A+ o B– desplazará el equilibrio hacia disminuir la concentración de los iones, hasta que estas concentraciones satisfagan los Kps. Por lo tanto, ocurre la formación de precipitado.
En presencia de precipitado, la adición del Ion común desplaza el equilibrio hacia la formación del electrolito sólido, de modo a mantener constante el producto de las concentraciones de los iones.
La adición del electrolito sólido no altera el equilibrio ni el número de iones en solución.
Previsión de Precipitación
Cuando mezclamos dos electrolitos diferentes, en solución, es posible saber cuando el precipitado se comenzará a formar, a partir de dos iones de esos electrolitos.
Por ejemplo: Son mezclados volúmenes iguales de Pb(NO3)2 0,2 M e KI 0,2 M. Habrá la formación de un precipitado de PbI2.
Dado: Kps do PbI2 = 1,4 · 10–8
Para responder a la pregunta, primero debemos encontrar la concentración de cada íon en solución:
Solución
Cuando las dos soluciones son mezcladas, el volumen de la solución final duplica, por lo tanto las concentraciones de Pb2+ y I – caen por la mitad
La ecuación iónica que representa la precipitación queda:
Pb2+(aq) + 2l –(aq) => PbI2(s)
Siendo que su inverso representa la disolución del PbI2 . Al alcanzar el equilibrio tenemos:
PbI2(s) <=> Pb2+(aq) + 2I–(aq)
Qps es el cociente de la reacción, siendo calculado en función de la concentración de iones que son mezclados. La precipitación ocurre cuando Qps es mayor o igual a Kps. Em nuestro caso, encontramos:
Qps = [Pb2+] · [i–]2
Qps = (0,1) · (0,1)2
Qps = 1,0 · 10–3
Como Kps = 1,4 · 10–8 se concluye que Qps > Kps, por lo tanto ocurre precipitación.