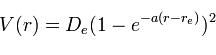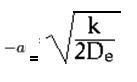Potencial de Morse
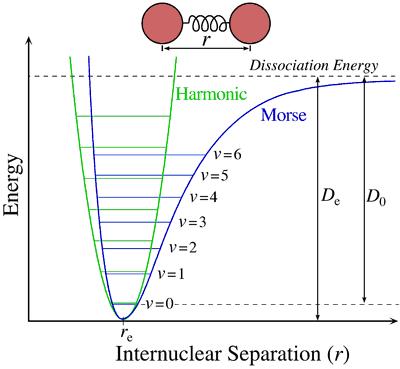
El potencial de Morse, nombrado de esta manera en homenaje al físico Philip M. Morse, es utilizado para describir la interacción entre los dos átomos que forman parte de una molécula diatómica. Las gráficas que se observan a continuación describen la energía potencial en función de la distancia entre los dos átomos.
El potencial de Morse es usado con frecuencia para estudiar la interacción entre dos átomos A y B, que conduce a la formación de una molécula diatómica AB.
A + B == > AB
Este potencial puede ser representado con la siguiente fórmula:
Donde V (r) es el potencial de Morse, r es la distancia entre los dos átomos y
De , -a y re son constantes que dependen del sistema en estudio.
Por ejemplo, para la molécula de hidrógeno, estos valores son:
De = 7.61×10−19 J, -a = 0.0193pm−1 y re = 74.1 pm
El valor -a se puede describir según la siguiente fórmula:
Donde k es la constante de fuerza de enlace.
Como observamos en la gráfica de arriba, según el potencial de Morse, la energía es mínima cuando la distancia entre los dos átomos es igual a re.
Esto se debe a que re es la distancia de enlace de los átomos en cuestión. Si la distancia entre los átomos es mayor o menor que este valor, la energía aumenta, describiendo en la gráfica una curva con un cierto parecido a la del movimiento oscilatorio armónico simple.
Si los átomos se encuentran más cerca que el punto de menor energía, surgen fuerzas de repulsión, que causan inestabilidad en el sistema, aumentando la energía potencial. Si los átomos se encuentran alejados, la energía potencial de los átomos por separado en mayor que si se encuentran a la distancia re.
La verdadera energía de disociación de enlace no es De, sino que el valor real de esta energía es D0, dada la energía del sistema en el punto vibracional más bajo (v = 0).
En la gráfica de arriba, observamos claramente que el potencial de Morse describe una curva asimétrica (a diferencia de la gráfica del movimiento armónico simple, cuya curva es simétrica), siendo una línea casi vertical desde el punto re hacia la izquierda, y más aplanada desde ese punto hacia la derecha. Esto significa se que requiere mayor energía aproximar aún más dos átomos enlazados, que para separarlos.
De todas maneras, hay que tener en cuenta que las moléculas diatómicas no se encuentran estáticas, sin que oscilan levemente desde el punto re hacia la izquierda, hasta el punto de retorno P, donde las fuerzas repulsivas hacen que la distancia entre los átomos aumente nuevamente, pasando por el punto re, y oscilando hacia la derecha esta vez, hasta el punto de retorno Q, donde las fuerzas de atracción entre los átomos, hacen que la distancia se acorte otra vez.