Polaridad
Enlaces moleculares y puentes de hidrógeno
Los átomos son constituyentes de la materia en los cuales las cargas eléctricas positivas de los protones y negativas de los electrones se equivalen y neutralizan entre si. Cuando los átomos se unen en enlaces tienden a conservar esa neutralidad eléctrica, manteniendo equiparado el número total de protones y electrones.
En los enlaces iónicos, esta interacción se da por la cesión de uno o más electrones por uno de los átomos del enlace que los tenía en exceso en su electrosfera (característica de los metales) y la recepción de ellos por otro que los tenía en falta (típico de los no metales).
Como la suma de los electrones perdidos por uno de los miembros del enlace es igual a la suma de los ganados por el receptor, cada átomo encuentra su nivel óptimo de capas de electrones en cuanto a la unión de ambos hace con que el conjunto se mantenga eléctricamente neutro.
Enlaces moleculares
Los enlaces moleculares o covalentes siguen otro mecanismo. Ese tipo de enlace se da entre dos no metales. Como no metales son elementos químicos que precisan ganar electrones para estabilizarse, o sea, encontrar el nivel óptimo de distribución de las capas de su electrosfera, tenemos un enlace en que todos los átomos involucrados están propensos a recibir electrones, pero no a cederlos.
La solución se da a través de compartirlos. Los átomos enlazados comparten uno o más electrones que pasan a complementar las electrosferas de ambos simultáneamente, como necesitaban. Estos enlaces, como vimos, son llamados como covalentes o moleculares y los grupos de átomos enlazados por ellos son llamados moléculas.
Las moléculas también son eléctricamente neutras, una vez que sus átomos comparten uno o más pares de electrones, pero conservan la equivalencia entre el número de cargas positivas de los protones del núcleo y el número de cargas negativas de los electrones que lo orbitan.
Electronegatividad
Solo que la observación reveló algunos comportamientos en las moléculas difíciles de explicar sin admitir que de algún modo sus cargas eléctricas continuasen actuando. Estos comportamientos comenzaron a ser explicados por el descubrimiento de la electronegatividad, propiedad que mide la tendencia de un átomo para atraer electrones.
Así, en un enlace covalente, los electrones tienden a quedar más próximos del átomo de mayor electronegatividad, que los atrae más intensamente.
En la tabla periódica, la electronegatividad aumenta desde abajo hacia arriba en los grupos (verticales de la tabla) y de izquierda a derecha en los períodos (horizontales de la tabla).
Así, los elementos químicos de menor electronegatividad se encuentran en la esquina inferior izquierda de la tabla y los de mayor en la esquina superior derecha, con el valor de esta propiedad creciendo a través de la tabla periódica a lo largo de una diagonal como se ve a continuación:
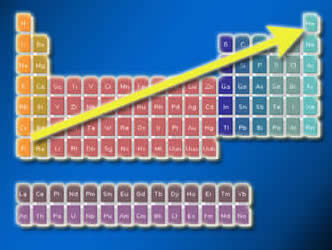
La flecha amarilla representa la tendencia de aumento de la electronegatividad de los elementos químicos a lo largo de la tabla periódica.
El efecto de la electronegatividad sobre las moléculas y que los electrones compartidos no lo son de una forma equitativa. Los átomos más electronegativos traen los electrones para cerca de si y acumulan en su proximidad sus cargas eléctricas negativas.
Por consecuencia, los átomos menos electronegativos están mas distantes de los electrones y en las proximidades de ellos, las cargas positivas tienden a predominar.
Moléculas con dos polos
El resultado es que las moléculas que presentan esta característica desarrollan dos polos eléctricos, uno negativo próximo al átomo más electronegativo donde los electrones se concentran y otro polo positivo, próximo al átomo menos electronegativo, que queda distante de los electrones y así evidencia más las cargas positivas de sus protones.
Uno de los mejores ejemplos de molécula polar es el agua, que enlaza dos átomos de hidrógeno y uno de oxígeno. Como el oxígeno se sitúa en la esquina superior derecha de la tabla, es uno de los elementos químicos de mayor electronegatividad, perdiendo apenas para el flúor, situado a su lado.
Pues bien, el oxígeno es mucho más electronegativo que los dos átomos de hidrógeno, con los cuales comparte dos pares electrónicos formando un enlace covalente. De esa forma el oxígeno jala hacia así los electrones compartidos, formando un polo eléctrico negativo de su periferia, en cuanto un polo positivo se forma en torno de los átomos de hidrógeno, que pierde la lucha por los electrones para su vecino más electronegativo, como se representa a continuación:
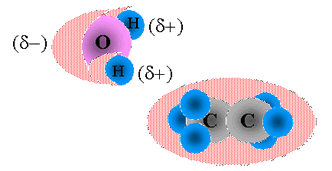
El agua es una molécula polar, en la cual las nubes de electrones (representadas en rojo) tienden a concentrarse próximas del elemento más electronegativo, el oxígeno. Ya, la molécula apolar de etano (debajo) presenta una distribución simétrica de los electrones.
La figura anterior también ilustra la diferencia entre una molécula polar como el agua y otr apolar como el etano. En esta última, los dos átomos de carbono que constituyen la molécula junto con seis de hidrógeno no forman polos positivo y negativo por cuenta de la distribución uniforme de los electrones, consecuencia del equilibrio de las electronegatividades.
Puentes de Hidrógeno
Uno de los efectos de la polaridad de las moléculas son los puentes de hidrógeno. Estos puentes surgen cuando el polo positivo formado por el hidrógeno en una molécula es atraído por el polo negativo de otra molécula también polar.
En el caso del agua, los hidrógenos de una molécula son atraídos por el oxígeno de la otra, por causa de sus polaridades eléctricas contrarias, como es representado en la próxima figura.
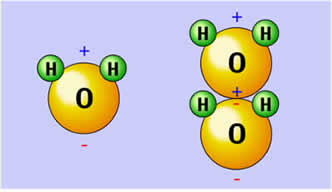
Los puentes de hidrógeno se forman en el agua cuando el oxígeno negativamente polarizado, atrae el polo positivo formado por los hidrógenos de otra molécula de agua.
Los puentes de hidrógeno afectan la estructura del H2O y son responsables por algunas de sus propiedades peculiares, como el hecho de que el agua aumenta de volumen cuando pasa de estado líquido al sólido, al contrario de lo que ocurre con la mayoría de las sustancias que disminuyen de volumen a lo largo del cambio de fase.
También son los puentes de hidrógeno que confieren al agua la capacidad de disolver sales y otras sustancias polares, cuyas moléculas o iones se separan de su formación original para alinearse siguiendo la atracción electroestática de los polos negativo y positivo del oxígeno. Por esto el agua es conocida como el solvente universal.

