Pila galvánica
Célula, célula galvánica, pila galvánica o celda voltaica es un dispositivo que utiliza las reacciones redox para convertir la energía química en energía eléctrica. La reacción química utilizada es siempre espontánea.
Este dispositivo, dispone de dos electrodos que suelen ser de diferentes metales, que proporcionan una superficie sobre la que ocurren las reacciones de oxidación y reducción. Estos electrodos se colocan en dos compartimentos separados, a su vez inmersos en un medio que contiene iones en concentraciones conocidas, separados por una placa porosa o membrana, que puede estar compuesta por acristalamiento arcilla, porcelana u otros materiales.
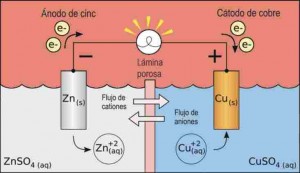
Las dos mitades de esto se llaman células electroquímicas y los compartimentos están diseñados para separar los dos reactivos que participan en la reacción redox, de lo contrario los electrones se transfieren directamente desde el agente reductor de agente oxidante. Por último, los dos electrodos están conectados por un circuito eléctrico, que se encuentra fuera de la célula, llamado el circuito externo, garantizando el flujo de electrones entre los electrodos.
Las baterías no deben confundirse con la pilas. Si bien sólo la primera energía química se convierte en electricidad, la segunda es la interconversión entre la energía eléctrica y química.
Es importante saber que en la célula, los electrones fluyen desde el ánodo al cátodo, y la dirección de la corriente eléctrica, de uso común en la física, es desde el cátodo al ánodo.
Historia
En el siglo XVII, Otto von Guericke inventó la primera máquina para producir electricidad.
En la segunda mitad del siglo XVIII, Luigi Galvani Aloisio comenzó la investigación sobre la aplicación terapéutica de la electricidad. Después de diez años de investigación publicadas en las fuerzas de la electricidad en los movimientos musculares, llegó a la conclusión de que los músculos almacenan la electricidad (de la misma manera que una botella de Leiden ) y los nervios rse encargan de la realización de la electricidad.
En el siglo XVIII, Alessandro Volta, poniendo en práctica la experiencia de Luigi Galvani, descubrió algo curioso. Encontró que si dos metales diferentes se ponen en contacto entre sí, uno de los metales es ligeramente negativo y el otro ligeramente positivo. Se establece entre ellos es decir, una diferencia de potencial, una tensión. Utilizando esta experiencia como base, concebida de una célula, que él llamó pila voltaica.
La célula consistía en discos de zinc y cobre apilados y separados por piezas de paño empapado en una solución de ácido sulfúrico. Esta célula produce electricidad cuando un hilo es adjunto a los discos de zinc y cobre, situado en el extremo de la pila.
En 1812, Davy produjo un arco con electrodos de carbono conectados a una batería de muchos elementos.
El funcionamiento de una celda galvánica
Supongamos, por ejemplo, para separar físicamente con nosotros en la barra de una solución de sulfato de zinc con el cobre. El zinc se encuentra inmerso en una solución de sulfato de cobre, así como una barra de cobre. Las dos barras están conectadas eléctricamente por un alambre. Este dispositivo forma una pila.
Las barras de electrodos de zinc y el cobre son conocidas y proporciona una superficie sobre la que ocurren las reacciones de oxidación y reducción. Si los electrodos de zinc y el cobre están unidos entre sí a través de un circuito externo, habrá un flujo de electrones a través de este circuito, el electrodo de zinc al cobre, cuya superficie será recibida por el Cu +2.

