Orden de Reacción
En cinética química, el orden de reacción con respecto a cierto reactivo, es definido como la potencia (exponencial) a la cual su término de concentración en la ecuación de tasa es elevado.
Por ejemplo, dada una reacción química 2A + B — > C con una ecuación de tasa
r = k [A]2 [B]1
el orden de reacción con respecto a A sería 2 y con respecto a B sería 1, el orden de reacción total sería 2 + 1 = 3. No es necesario que el orden de una reacción sea un número entero; cero y valores fraccionarios de orden son posibles, pero ellos tienden a ser enteros. Ordenes de reacción pueden ser determinados solamente por experimentos. Su conocimiento conduce a conclusiones sobre el mecanismo de reacción.
El orden de reacción no está necesariamente relacionado a la estequiometría de la reacción, a menos que la reacción sea elemental. Reacciones complejas pueden tener o no órdenes de reacción iguales a sus coeficientes estequiométricos.
Una determinación importante en el estudio de la cinética de una reacción química es la del orden de reacción. Conviene recordar, en los casos más simples, lo que se entiende por orden de reacción. Siendo Co la concentración inicial del reactivo y C la concentración del reactivo pasado el tiempo t de reacción, si dC/dt obedeciese a la ecuación (1), n será el orden de reacción.
![]()
Si n = 0 (reacción de orden cero), la ecuación (2) será obtenida a partir de la ecuación (1)
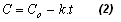
En los casos de n = 1 (reacción de orden uno, o de primer orden) y n = 2 (reacción de orden dos, o de segundo orden), la ecuación (1) conducirá, respectivamente, a las ecuaciones (3) y (4).
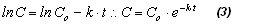
![]()
Si medimos, durante un experimento, los valores de C en diferentes instantes t, en los casos aquí considerados, serán obtenidos los gráficos esquemáticamente representados en la figura a continuación.
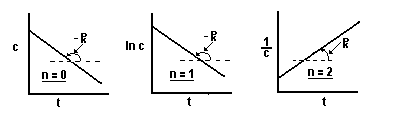
Variación de la concentración del reactivo (C) en función del tiempo (t) para tres valores del orden de reacción (n).
Ejemplo Numérico:
Supongamos que, en un experimento, hayan sido obtenidos los resultados indicados en la Tabla 1

Se trata de una reacción relativamente lenta, una vez que, transcurrida 16 horas, la concentración del reactivo aún era igual a 44,7% de la inicial.
A partir de los valores de la Tabla 1, por regresión linear, las ecuaciones (2), (3) y (4) conducen respectivamente, las ecuaciones (5), (6) y (7) (ver Figura 2), siendo r el coeficiente de correlación.
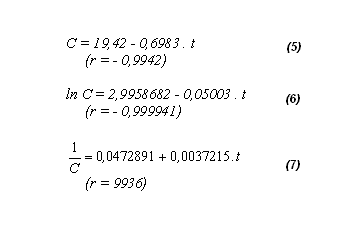
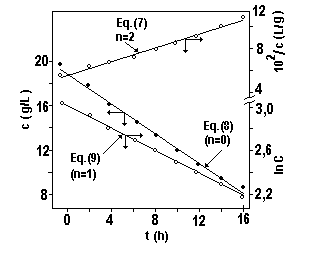
Figura 2: Valores experimentales de C y rectas obtenidas para tres valores de n en el Ejemplo Nº1 con duración de 16 horas. Para no sobrecargar la figura no fueron representados todos los valores de la Tabla 1.
Las ecuaciones (5), (6) y (7) (o la Fugura 2) muestran que la ecuación (6) es la que, seguramente, presenta mejor ajuste, permitiendo concluir que la reacción es de primer orden (n = 1) con k = 0,0500h-1.
Supongamos, entonces, que el experimento tuviese sido interrumpido en el instante t = 4 h, esto es, cuando la concentración del reactivo era 82,0% de la inicial.
En este caso, las ecuaciones (8), (9) y (10) tendrían sido obtenidas (ver Figura 3).
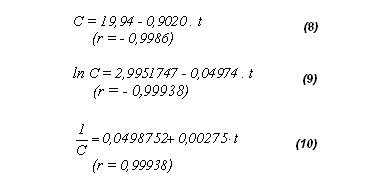
Las ecuaciones (8), (9) y (10) (o la Figura 3) no permiten, con seguridad, determinar el valor de n.
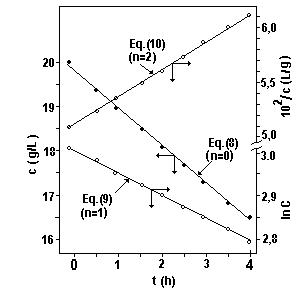
Figura 2: Valores experimentales de C y rectas obtenidas para tres valores de n considerando las primeras 4 horas del Ejemplo Nº 1
Indicándose por D a la media de los valores absolutos de las diferencias entre los valores de C calculados por una de las ecuaciones (5) a (10) y los correspondientes valores experimentales de C, la Tabla 2 muestra los resultados obtenidos.

En resumen, si a partir de todos los valores de la Tabla 1 fue posible determinar el orden de la reacción, lo mismo no sucedió cuando fueron considerados los valores obtenidos en las cuatro primeras horas del experimento.
Este ejemplo numérico ilustra bien lo que dice Levenspiel en su libro Ingeniería de las Reacciones Químicas “La decisión de saber si la línea recta ofrece un buen ajusta es generalmente hecha intuitivamente, usando un buen juicio cuando se examinan los datos. Si existe alguna duda, más datos deben ser obtenidos”.

