Enlace peptídico
En la figura de abajo, observamos cómo dos aminoácidos se unen mediante un enlace covalente para formar un dipéptido. El grupo carboxilo (COOH) del primer aminoácido reacciona con el grupo amino (NH2) del segundo, desprendiéndose una molécula de agua y formándose un enlace entre el carbono y el nitrógeno (CO-NH).
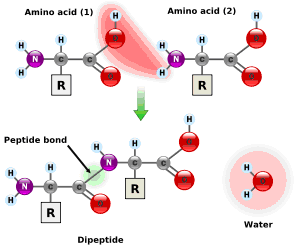
El dipéptido formado puede enlazarse mediante su grupo carboxilo libre con otro grupo amino de otro aminoácido y así formar polipéptidos y proteínas.
El dipéptido se nombra agregando el sufijo –il al primer aminoácido. Por ejemplo si el primer aminoácido es alanina y es segundo valina, el nombre del dipéptido será alanil-valina.
El enlace peptídico tiene características especiales. Por ejemplo, se podría suponer que la proteína formada por la unión de varios aminoácidos puede conformarse tridimensionalmente de varias maneras, dado los posibles giros de los enlaces. Sin embargo, cada proteína tiene sólo una conformación tridimensional natural, llamada conformación nativa, la cual está estrechamente ligada a la función que cumple dicha proteína.
Esto de debe a que efectivamente, los enlaces no pueden girarse libremente. Mediante técnicas de difracción de rayos X, se encontró que el enlace peptídico es un poco más corto que el enlace sencillo entre carbono y nitrógeno(146 picómetros), del entrono de 133 picómetros. Esto es consecuencia de que existe un efecto de resonancia de electrones deslocalizados, que brindan estabilidad y fuerza a este enlace, acortando la longitud del mismo.
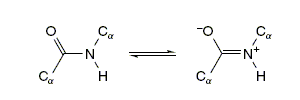
Otra consecuencia importante del efecto de resonancia, es el momento dipolar del enlace peptídico, que le brinda polaridad y le permite formar puentes de hidrógeno.
Dada la rigidez del enlace peptídico, los átomos que lo forman y los carbonos que están unidos a él, se disponen en planos paralelos, como se observa en la siguiente figura.
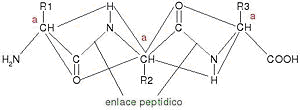
Esta ordenación del enlace está dada por la estabilización que brindan los electrones deslocalizados, y es lo que causa que no haya muchas posibilidades diferentes en la conformación de una proteína.
Los enlaces contiguos al enlace peptídico, es decir el enlace entre carbono alfa y carbono en el primer aminoácido, y el enlace entre nitrógeno y el carbono alfa en el segundo aminoácido, sí poseen ángulos de giro (a diferencia del enlace peptídico que se encuentra entre ellos, que como ya se dijo, es rígido).
Estos ángulos de giro se denominan phi, para en enlace carbono-nitrógeno, y psi, para el enlace carbono-carbono. Los valores de phi y psi son conocidos para cada aminoácido, por lo tanto cuando dos aminoácidos se unen en enlace peptídico podemos predecir según estos valores que conformación tendrá el péptido.
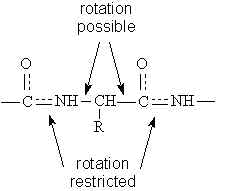
El tamaño y características del grupo R de cada aminoácido también tiene influencia en el ángulo de enlace entre nitrógeno y carbono y entre dos carbonos. Esto también restringe las posibilidades de giro de los enlaces.
Un giro que sí es posible es el de la posición del carbono y el hidrógeno unidos al nitrógeno, dando lugar a posiciones cis y trans, como se ve en la figura que sigue:
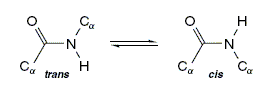
La posición trans es la hallada con mayor frecuencia.

