Energía de Activación
El acontecimiento de una reacción química está obligatoriamente relacionado con el contacto entre moléculas reactivas y a una energía mínima necesaria. Esta energía mínima para el acontecimiento de la reacción es llamada como energía de activación.
La formación de los productos a partir de los reactivos es un proceso gradual en que los enlaces de los reactivos son rotos en paralelo con la formación de los enlaces de los productos. Este estado intermedio en que algunos enlaces están semi-rotos y otros semi-formados es conocido como “complejo activado”.
Otra exigencia para la formación del complejo activado es que las moléculas reactivan colisiones con orientación favorable a la formación del mismo
Colisiones con energía y orientaciones adecuadas a la formación del complejo activado, son llamadas como colisiones efectivas. Estos son los principios básicos de la Teoría de Colisión.
Dada la siguiente reacción:
H2 + I2 —-> 2 HI
Verifiquemos en la tabla a continuación, en la primer línea una orientación que lleva a una colisión no efectiva y en la segunda línea una que lleva a una colisión efectiva
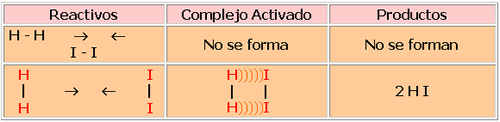
No todas las colisiones son efectivas, en tanto, todas en que el complejo activado es alcanzado llevan a la formación de los productos.
Complejo activado es una estructura intermedia entre los reactivos y los productos, con enlaces intermediarios entre los dos reactivos y los dos productos.
La energía de activación de la reacción corresponde a la energía necesaria para que la reacción se efectúe con menos energía de los reactivos. Cuanto más baja fuese la energía de activación de una reacción, más elevada será la velocidad de la misma.
Una reacción se llama exotérmica cuando provee para el medio una energía más alta que la necesaria para alcanzar el complejo activado.
Cuando una reacción es endotérmica, ella provee para el medio una energía más baja que la necesaria para alcanzar el complejo activado.
Catalizadores son sustancias que disminuyen la energía de activación para una dada reacción, sin alterar el ΔH de la misma. Los catalizadores no se alteran durante las reacciones.
En la autocatálisis, uno de los productos de la reacción actúa como catalizador, al inicio de la reacción es lenta con la formación de este la velocidad va aumentando gradualmente.
En la catálisis homogénea, catalizador y reactivos se encuentran en la misma fase. En la catálisis heterogenea, catalizador y reactivos se encuentran en fases diferentes.
Las enzimas son catalizadores que actúan en reacciones biológicas y generalmente son bastante específicas y presentan temperatura óptima de actuación en el entorno de los 37º.

