Elementos metálicos
Hemos visto anteriormente que todos los elementos pueden ser clasificados en metálicos, no metálicos, o metaloides. Hasta ahora estudiamos teorías fundamentales de la química, como enlaces químicos, fuerzas intermoleculares, equilibrio químico, electroquímica entre otras. Todos estos conocimientos son necesarios para comprender la química de los elementos en particular de los metales.
Esta química inorgánica descriptiva es necesaria para la comprensión de la utilidad y aplicación de la química en los variaos procesos industriales y biológicos (incluyendo organismos vivos).
La mayoría de los metales provienen de los minerales. Un mineral es una sustancia que ocurre naturalmente y con composición química definida.
La metalurgia es la ciencia de la separación de los metales de los minerales y la fabricación de aleaciones de metales.
Involucra: a) preparación del mineral; b) producción del metal; c) purificación
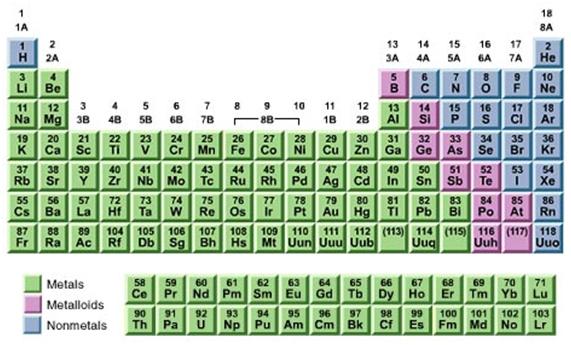
La producción de un metal libre es siempre un proceso de reducción. A veces es necesario previamente calcinar el mineral para expulsar impurezas volátiles.
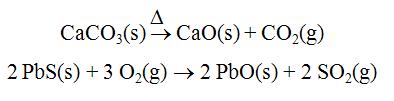
Los procesos más importantes son realizados en altas temperaturas en un proceso conoido como pirometalurgia.
Procesos de reducción
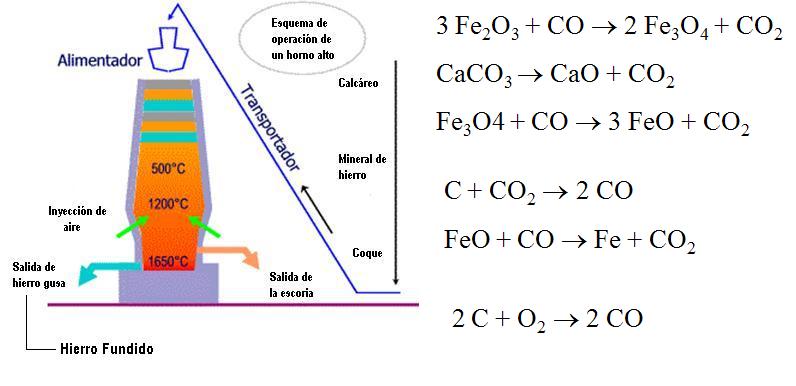
Metalurgia del Hierro
El hierro existe en la forma de ciertos minerales como la pirita (FeS) y a hematita (Fe2O3). El proceso involucra la reducción química de los minerales por el carbono (en la forma de coque) en un horno alto.
Producción del acero
La fabricación del acero es una industria fundamental. En tanto la producción del hierro es un proceso de reducción, la conversión en acero es un proceso de oxidación. Las impurezas indeseables son removidas con oxígeno gaseoso.
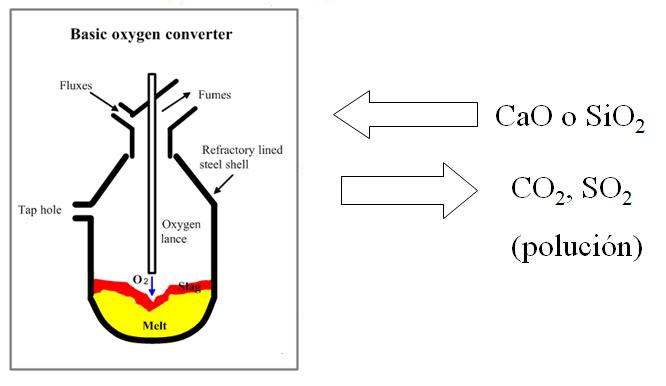
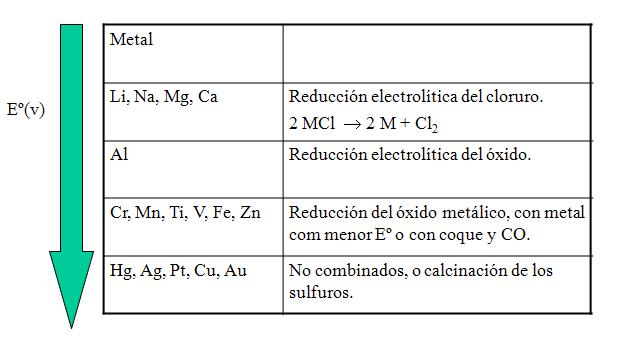
Purificación metálica
Destilación: metales con puntos de fusión bajos pueden ser purificados por destilación fraccionada. Ejemplo: método de Mond para la purificación del Níquel.
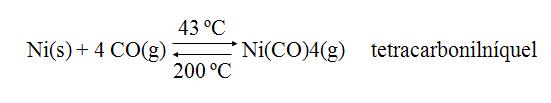
Electrólisis: Como ejemplo el cobre
Metales alcalinos
Son los elementos menos electronegativos. Estado de oxidación +1. Poseen puntos de fusión y densidad bajos.
Sódio, Na
Ocurren: NaAlSi3O8 (albita); NaCl; NaNO3(nitrato de Chile)
Obtención: electrólisis del NaCl fundido (pila de Downs)
Reacciones principales:
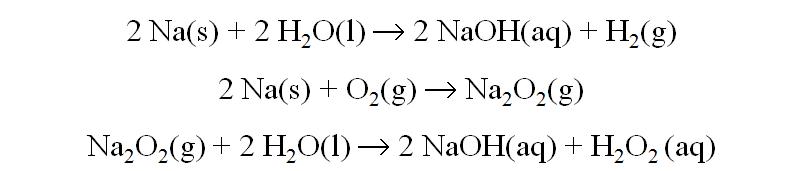
Potássio, K
Ocurren: KAlSi3O8 (ortoclasa); KCl
Obtención: destilación del KCl fundido a 892 ºC.
Reacciones Principales:
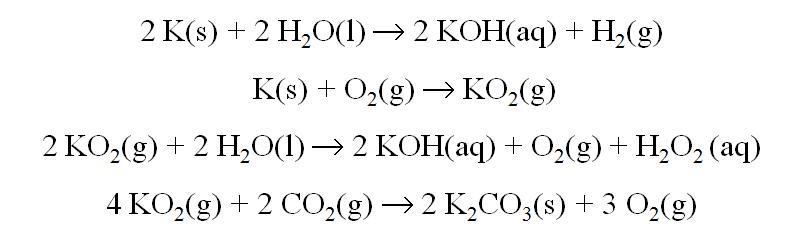
Aplicaciones
Na2CO3: tratamiento de aguas, fabricación de jabones, detergentes, medicamentos, industria del vidrio.
Hidróxidos: productos de jabones, electrolitos de bacterias, …
Nitratos: fertilizantes, explosivos, ….
Metales alcalino térreos: Magnesio, Mg
Ocurren: Mg(OH)2(brucita); CaCO3.MgCO3 (dolomita); MgSO4.7 H2O (epsomita).
Obtención: electrólisis del MgCl2 fundido (obtenido del agua del mar)
Reacciones Principales:
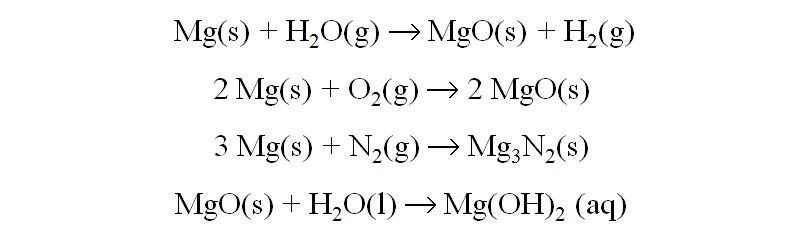
Cálcio, Ca
Ocurre: CaCO3 (calcáreo, tiza y mármol); CaSO4.2 H2O (yeso); CaF2 (fluorita)
Obtención: electrólisis del CaCl2 fundido
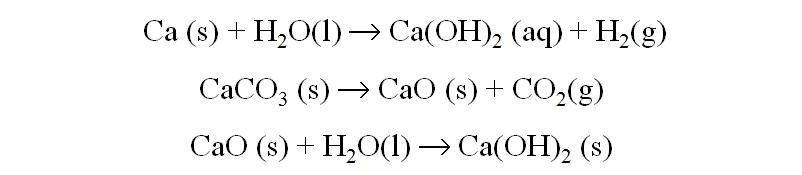
Aplicaciones
Magnesio: enlaces metálicos; protección catódica; baterías,…
CaO: metalurgia, remoción del SO2, regulación de la acidez de los suelos, …
Ca(OH)2: tratamiento de aguas
Alumínio, Al
El aluminio es el metal más abundante y es el tercer elemento más presente en la corteza terrestre (7,5%).
Posee baja densidad, elevada resistencia a la tracción y es un excelente conductor eléctrico.
Ocurre: Al2O3. 2 H2O (bauxita); Be3Al2Si6O18 (berilo); Na3AlF6 (criolita); Al2O3 (corindón).
Obtención: electrólisis del óxido de aluminio anhidro, por el proceso de Hall-Heroult.
Reacciones Principales
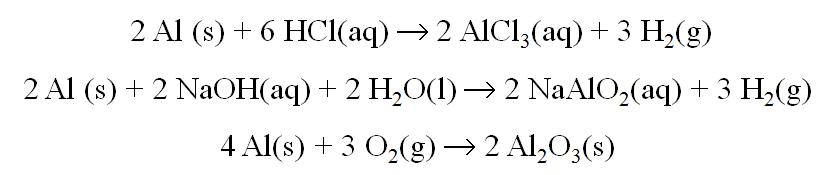
Aplicaciones
Aluminio: líneas de transmisión de alta tensión; construcción de aeronaves, recipientes; propulsor sólido para cohetes.
Reciclado: El aluminio es utilizado en millones de toneladas de latas de refrescos. Para reciclar el aluminio es apenas necesaria la energía de calentarlo hasta el punto de fusión (~ 660 ºC) y la energía de fusión ( ~10.7 kJ/mol).
En total, la energía para reciclar un mol de aluminio es cerca del 9% de energía necesaria para producir igual cantidad de el por electrólisis.

